本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.《物质结构与性质》2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。砷化镓的品胞结构如图10。试回答:
图10
(1)镓的基态原子的电子排布式是 。
(2)砷化镓品胞中所包含的砷原子(白色球)个数为 ,与同一个镓原子相连的砷原子构成的空间构型为 。
(3)下列说法正确的是 (填字母)。
A.砷化镓品胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
E.GaP与GaAs互为等电子体
(4)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是 。
(5)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式
为 。
B.《实验化学》某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
⑴提出假设
①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是 。
⑵设计方案 如图11所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
图11
⑶查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: 。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
⑸数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式 。 ⑹实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案: 。
在室温和大气压强下,用图示的装置进行实验,测得
含
90%的样品与水完全反应产生的气体体积
。现欲在相同条件下,测定某电石试样中
的质量分数,请回答下列问题: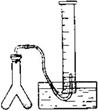
(1)
和水反应的化学方程式是。
(2)若反应刚结束时,观察到的实验现象如图所示,这时不能立即取出导气管,理由是。
(3)本实验中测量气体体积时应注意的事项有。
(4)如果电石试样质量为
,测得气体体积为
,则电石试样中
的质量分数计算式
(
)=。(杂质所生成的气体体积忽略不计)。
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、泥三角、玻璃棒、药匙、托盘天平
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量过的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是;
(2)指出实验步骤中存在的错误并改正:;
(3)硫酸钠不能放置在空气中冷却的原因是;
(4)步骤⑤的目的是;
(5)下面的情况有可能造成测试结果偏高的是(填序号)。
| A. | 试样中含有加热不挥发的杂质 |
| B. | 试样中含有加热易挥发的杂质 |
| C. | 测试前试样已有部分脱水 |
| D. | 实验前坩埚未完全干燥 |
E.晶体加热脱水不完全
F.加热时晶体溅出
一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0 ,与反应前的体积相比,反应后体积缩小的百分率是()
| A. | 16.7 | B. | 20.0 |
| C. | 80.0 | D. | 83.3 |
水蒸气通过灼热的焦炭后,流出气体一的主要成分是
和
,还有
和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有
和
。(加热装置和导管等在图中略去)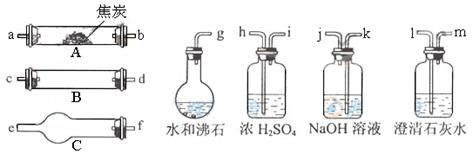
回答下列问题:
(1)盛浓
的装置用途是。
盛 溶液的装置用途是。(2)仪器B中需加入试剂的名称(或化学式)是:。
所发生反应的化学方程式是:。
(3)仪器C中需加入试剂的名称(或化学式)是:。
其目的是。
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:
。
(5)能证明混合气体中含
的依据是。能证明混合气体中含
的依据是。
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作
用是:。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管II再测有机层的厚度,实验记录如下:
| 实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
| A |
3 mL乙醇、2 mL乙酸、1mL18mol·L-1浓硫酸 |
饱和Na2CO3溶液 |
5.0 |
| B |
3 mL乙醇、2 mL乙酸 |
0.1 |
|
| C |
3 mL乙醇、2 mL乙酸、6 mL 3mol·L-1 H2SO4 |
1.2 |
|
| D |
3 mL乙醇、2 mL乙酸、盐酸 |
1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是__________mL和__________mol·L-1。
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是。