对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.0.1mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C.将0.2mol·L-1NaA溶液和0.1mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.在25℃时,1mol/L的Na2S溶液中:c(OH-)= c(H+)+c(HS-)+2c(H2S) |
下列物质属于化合物的是
| A.HCl | B.O2 | C.Br2 | D.Ar |
下图为农夫山泉矿泉水瓶上的部分说明文字,列出了该饮用天然水理化指标。这里的钙、镁、钾、钠是指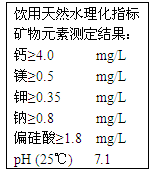
| A.原子 | B.分子 | C.单质 | D.元素 |
对元素周期表和元素周期律的发现有突出贡献的科学家是
| A.拉瓦锡 | B.阿伏加德罗 | C.门捷列夫 | D.道尔顿 |
下列关于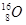 的叙述正确的是
的叙述正确的是
| A.质量数为8 | B.质子数为8 | C.中子数为16 | D.电子数为16 |
标准状况下,将NO2和NO组成的混合气体4.48L通入100mL水中,充分反应后,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中不正确的是
| A.所得溶液中溶质物质的量浓度为1.0 mol·L-1 |
| B.原混合气体中NO2和NO的体积比为1∶1 |
| C.反应过程中转移的电子总数为0.1mol |
| D.若将原混合气体和1.68 L(标准状况)O2混合后再通入100 mL水中,则充分反应后,不会有气体剩余 |