一定温度下,在体积为 VL 的密闭容器中加入1molX和1molY进行如下反应:
X(g) + Y(g ) 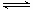 2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是( )
2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是( )
| A.向平衡混合物中加入少量W,正、逆反应速率均增大 |
| B.平衡后加入X,上述反应的△H增大 |
| C.温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的1/2 |
| D.当容器中混合气体的压强不变时,可以证明此反应已达到平衡状态 |
下列说法正确的是()
| A.一定条件下,增加反应物的量,必定加快反应速率 |
| B.升高温度正反应速率增大,则逆反应速率也一定增大 |
| C.可逆反应的特征是正反应速率总是和逆反应速率相等 |
| D.使用催化剂一定会加快反应速率 |
下列各装置中都盛有0.1 mol·L-1的NaCl溶液,放置相同时间后,锌片的腐蚀速率由快到慢的顺序是()
| A.③①④② | B.①②④③ | C.②①④③ | D.②①③④ |
关于如图所示装置的叙述,正确的是()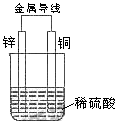
| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是()
| A.Mg 电极是该电池的正极 |
| B.H2O2在石墨电极上发生氧化反应 |
| C.石墨电极附近溶液的pH 增大 |
| D.溶液中Cl-向正极移动 |
现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸浓度为4mol/L,稀硝酸的浓度为2mol/L。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到气体体积为(假设HNO3只被还原为NO)( )
| A.0.224L | B.0.448L | C.0.672L | D.0.896L |