(14分) 能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g)
CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”),
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)的变化
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
I.由表中数据判断ΔH2 0(填“>”、“<”或“=”),
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是 ,
A.升高温度 B.将CH3OH(g)从体系中分离 C.使用合适的催化剂 D.充入He,使体系总压强增大 E.按原比例再充入 CO和 H2
Ⅲ.某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)="0.2" mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择);
(2)某实验小组依据甲醇燃烧的反应原理,设计如上图所示的原电池装置。
①该电池工作时,OH-向_______极移动(填“正”或“负”),
②该电池负极的电极反应为 。
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液②AgNO3溶液③KCl溶液④CuCl2溶液。通过相同电量时,阴极产生的气体物质的量相同的是(填序号)_________;通过相同电量时,产生的气体总物质的量由多到少的排列顺序是(填序号)__________。
Ⅱ.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)化学反应中放出的能量(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g)△H=-185 KJ/mol
E(H-H)=436 KJ/mol, E(Cl-Cl)=247 KJ/mol,则E(H-Cl)=_____
(2)已知Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)△H=-25 KJ/mol
(g)△H=-25 KJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47 KJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19 KJ/mol
请写出CO还原FeO的热化学方程式:_________________________________。
(3)如图所示的装置: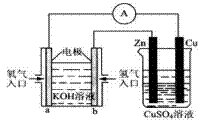
该装置中Cu极为_____极;当铜片的质量变化了12.8g时,a极上消耗的O2在标准状况下的体积为_______L。
我国规定饮用水质量标准必须符合下列要求:
| PH |
6.5~8.5 |
| Ca2+、Mg2+总浓度 |
<0.0045mol/L |
| 细菌总数 |
<100个/mL |
某综合实践活动小组到自来水厂参观,了解到源水处理成自来水的工艺流程示意图如下: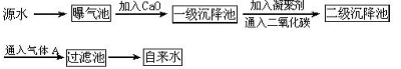
(1)源水中含有Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后发生若干个化学反应,请写出其中任意一个反应的离子方程式:_____________________________________
(2)加入絮凝剂可以除去其中的悬浮固体颗粒,该过程是____________________(填序号)
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有物理过程,又有化学过程
(3)FeSO4·7H2O是常用的絮凝剂,加入后最终生成红褐色胶状沉淀,则这种沉淀是___________(填化学式)
(4)通入二氧化碳的目的是__________和___________。
(5)物质A的作用是_________,则A可以选择下列物质中的__________(填序号)
①ClO2②SO2③液氯④Ca(ClO2)2⑤浓硫酸
有机物A的相对分子质量为198.5,其结构简式如下(-R-表某种烷基),已知在光照条件下,A分子中的一个氢原子被氯原子取代时只得到一种产物,A在一定条件下还有下图所示的反应关系: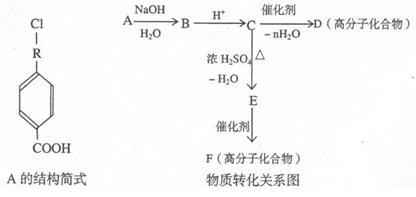
(1)A的分子式为;A的结构简式为。
(2)C→D的化学方程式为。
(3)写出E中所含官能团的名称;C→E的反应类型为。
A、B、C、D四种元素处于同一周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于A、B之间,D与B相邻。
(1)C原子的价电子排布式为。
(2)A、B、C三种元素原子的第一电离能由大到小的顺序是(写元素符号)。
(3)B的单质分子中存在个 键。
键。
(4)D和B形成一种超硬、耐磨、耐高温的新型化合物,该化合物属于晶体,其硬度比金刚石(填“大”或“小”)。
(5)A的气态氢化物的沸点在同族中最高的原因是。
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于硬水(填写“暂时”或“永久”)
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,加入顺序为,原因是。
(3)目前常用阴、阳离子交换树脂来进行水的软化,如水中的Ca2+、Mg2+与交换树脂的起离子交换作用。当阴离子交换树脂失效后可放入溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。 下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl- 、Ca2+、Mg2+、
下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl- 、Ca2+、Mg2+、 等离子,电极为惰性电极。请分析下列问题:
等离子,电极为惰性电极。请分析下列问题:
阳离子交换膜是指(填A或B)。