NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.标准状况下,22.4L苯的分子数约为NA个 |
| B.常温下,在18g18O2中含有NA个氧原子 |
| C.标准状况下,17g NH3所含共价键数为NA个 |
| D.1mol Na2O2中含有的阴离子数目为2NA个 |
A.Fe3+、NO 、Cl-、Na+ 、Cl-、Na+ |
B.Ca2+、HCO 、Cl-、K+ 、Cl-、K+ |
C.NH 、Fe2+、SO 、Fe2+、SO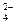 、NO 、NO |
D.Cl-、SO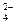 、K+、Na+ 、K+、Na+ |
| A.A>B | B.A=10-4 B |
| C.B=10-4A | D.A=B |
| A.107 | B.5.56×108 |
| C.1.0×10-14 | D.55.6 |
| A.1.0×10-7 mol·L-1 | B.1.0×10-6 mol·L-1 |
| C.1.0×10-2 mol·L-1 | D.1.0×10-12 mol·L-1 |
| A.2c(Na+)+c(H+)====c(S2-)+c(HS-)+c(OH-) |
| B.c(Na+)+c(H+)====2c(S2-)+c(HS-)+c(OH-) |
| C.c(H+)+c(HS-)+2(H2S)====c(OH-) |
| D.c(Na+)====2c(S2-)+2(HS-)+2c(H2S) |