元素性质呈周期性变化的决定因素是 ( )
| A.元素原子半径大小呈周期性变化 | B.元素原子量依次递增 |
| C.元素原子最外层电子排布呈周期性变化 | D.元素的最高正化合价呈周期性变化 |
图1和图2是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质是 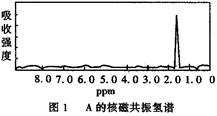
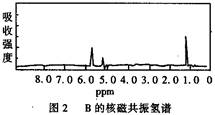
A.A是C 3H 6;B是C 6H 6B.A是C 2H 6;B是C 3H 6
C.A是C 2H 6 ;B是C 6H 6D.A是C 3H 6;B是C 2H 6
丁香油酚的结构简式是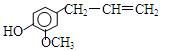 ,该物质不应有的化学性质是
,该物质不应有的化学性质是
①可以燃烧;②可以跟溴加成;③可以使酸性KMnO4溶液褪色;④可以跟NaHCO3 溶液反应;⑤可以跟NaOH溶液反应;⑥可以在碱性条件下水解
| A.①③ | B.③⑥ | C.④⑤ | D.④⑥ |
有机物丁香油酚的结构式为: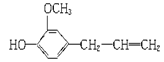 ,按官能团分类,它不属于
,按官能团分类,它不属于
| A.烯类 | B.酚类 | C.醚类 | D.醇类 |
在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应: 达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
A.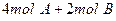 |
B.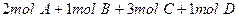 |
C.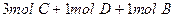 |
D.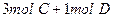 |
对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为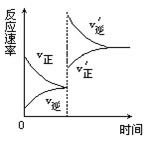
| A.Z、W均为气体,X、Y中有一种是气体 |
| B.Z、W中有一种是气体,X、Y皆非气体 |
| C.X、Y、Z、W皆非气体 |
| D.X、Y均为气体,Z、W中有一种为气体 |