设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,78g的苯含有3nA个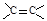 双键 双键 |
| B.1L 0.1 mol·L-1的NH4Cl溶液中有0.1nA个NH4+ |
| C.标准状况下,22.4 L SO2与CO2混合物含有2nA个O原子 |
| D.常温下,5.6 g铁块投入足量浓硝酸中失去0.3nA个电子 |
在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是:
| A.2Na2O2+2H2O=4NaOH+O2↑ |
| B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ |
| C.Cl2+H2O=HClO+HCl |
| D.NH4Cl+NaOHNaCl+NH3↑+H2O |
.A、B两元素的原子分别得到2个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量。若A、B、C、D间分别形成化合物时,属于离子化合物可能性最大的是:
A.D2AB.C2B
C.C2A D.D2B
氮化硼是一种新合成的结构材料,它的一种晶体类型与金刚石相似,是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时,所克服的微粒间作用力与氮化硼熔化所克服的微粒间作用力都相同的是:
| A.硝酸钠和金刚石 | B.硅晶体和水晶 |
| C.冰和干冰 | D.苯和萘 |
.下列说法正确的是:
| A.在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性 |
| B.由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物 |
| C.基态C原子有两个未成对电子,所以最多只能形成2个共价键 |
| D.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性 |
.根据元素在元素周期表中的相对位置,判断下列化合物中,化学键极性最大的是:
| A.H2S | B.CH4 | C.NH3 | D.H2O |