X、Y、Z三种气体都是大气污染物,在工业上通常用碱液吸收。已知X是化石燃料燃烧的产物之一,是造成酸雨的主要物质;Y是一种单质,其水溶液具有漂白性;Z是硝酸工业和汽车尾气的有害物质之一,易溶于水。请写出下列有关反应的化学方程式。
(1)X在一定条件下与氧气反应;
(2)Y与消石灰反应
(3)Z溶于水
(1)在下列变化中①I2升华,②烧碱熔化,③二氧化硅熔化,④NaCl溶于水,⑤H3PO4熔融,⑥O2溶于水,⑦Na2O2溶于水,⑧NaHSO4溶于水。未破坏化学键的是;仅离子键被破坏的是;仅共价键被破坏的是;离子键和共价键都被破坏的是。
(2)判断:①SiC,②CO2,③Br2,④KCl晶体的熔点由高到低排列的顺序:(序号)
已知
分别代表一种物质,它们之间的转化关系如下图所示(反应条件略)。
分别是由短周期元素组成的单质。
与冷水缓慢反应,与沸水迅速反应,放出氢气。
是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。
为淡黄色固体化合物,
能与
的水溶液反应生成蓝色沉淀。请回答下列问题:
⑴组成
单质的元素位于周期表位置。化合物
电子式为。
⑵
的沸点比硒化氢(
)的熔沸点高,其原因是。
⑶
与在一定条件下也可直接反应生成
和
, 写出化学方程式:。
⑷写出
与水反应的化学方程式:。
⑸红棕色污染气体
的处理具有实际意义。现在常利用反应
 (方程没配平)来处理
。当转移0.4
电子时,消耗的M在标准状况下是
。
(方程没配平)来处理
。当转移0.4
电子时,消耗的M在标准状况下是
。
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: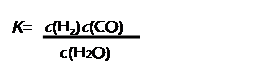
它所对应的化学反应为:
(2)已知在一定温度下,
C(s)+CO2(g) 2CO(g)平衡常数K1;
2CO(g)平衡常数K1;
CO(g)+H2O(g  H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g) CO(g)+H2(g)平衡常数K3;
CO(g)+H2(g)平衡常数K3;
则K1、K2、K3之间的关系是:。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
该反应的正反应方向是反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)  2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是。
(6)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式,阳极区逸出气体的成分为__________(填化学式)。
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需。
(2)酸浸时,为了提高浸取率可采取的措施有、
。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 |
Fe3+ |
Mg2+ |
Al3+ |
Cr3+ |
| 开始沉淀时的pH |
2.7 |
—— |
—— |
—— |
| 沉淀完全时的pH |
3.7 |
11.1 |
8 |
9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有;但溶液的pH不能超过8,其理由是。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是。
(6)写出上述流程中用SO2进行还原的化学方程式。
如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL。
⑴电源F为____________极;第②极为__________极;B池为___________池;
⑵A池中第②极上的电极反应式为_____________________;
A池中第①极上产生气体体积为__________________ mL;(标准状况下)
(3) 通电前A池中原混合溶液Cu2+的浓度为;