某学习小组利用右图装置完成如下实验,以验证所学物质的性质。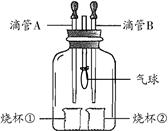
(1)若A中盛有浓盐酸,B中盛有紫色的石蕊试液,将A、B中液体分别滴入烧杯①、②中,一段时间后观察到的现象是 。
(2)化学反应通常伴随能量的变化,可借助反应前后的温度变化来判断是否发生了反应。在不使用温度计的情况下,若A中盛有稀盐酸,烧杯①中盛有固体氢氧化钠,将A中的稀盐酸滴入烧杯①,观察到气球变瘪,则证明反应发生了。有的同学提出:该现象不足以证明NaOH与稀盐酸发生了化学反应。他的理由是: 。(填一种即可)
(3)若将集气瓶中充满CO2,先将B中盛放的NaOH溶液滴入烧杯②中少量,会看到气球微微变鼓;再将A中的液体滴入烧杯①。请根据下列实验现象将下表中的试剂补充完整。
 现象 现象装置 |
① 气球变瘪又恢复原状 |
② 气球变瘪 |
③ 气球先变瘪后又变得更鼓 |
| 滴管A |
|
|
H2O |
| 烧杯① |
H2O |
固体Na2CO3 |
|
某研究性学习小组设计并进行了如下实验。
(1)甲组同学用右图装置制取干燥纯净的二氧化碳气体。请回答下列问题:
①仪器X的名称是 。实验前,关闭活塞,向X中加入水使X中液面高于试管中的液面,一段时间后液面保持不变说明 。
②为除去CO2中混有的HCl气体,B装置中盛放饱和NaHCO3溶液,写出该反应的化学方程式 。
③要得到干燥的CO2,C装置应盛放 (填试剂名称)。
④请说明装置B、C中试剂不能交换的原因: 。
(2)乙组同学围绕CO还原CuO产生的红色固体是否一定是Cu进行探究:
【查阅资料】 ①Cu2O粉末呈红色。在酸性溶液中:Cu2O+H2SO4=Cu+ CuSO4+H2O
②在空气中高温灼烧时:Cu2O稳定,而CuO将分解生成Cu2O和O2
【提出猜想】猜想Ⅰ:红色固体是Cu;猜想Ⅱ:红色固体是Cu2O;
猜想Ⅲ:红色固体是 。
【实验探究】步骤Ⅰ:取一定质量的红色固体a g ,在空气中高温灼烧,直到质量不再发生改变,称量所得固体质量为b g 。
步骤Ⅱ:数据分析
①若a =" b," 则猜想成立;
②若b>a, 则说明红色固体中一定含有物质;
步骤Ⅲ:另取少量红色固体投入稀硫酸中,充分反应后溶液呈蓝色。根据此现象,该红色固体中含有。写出由Cu生成Cu2O的化学方程式是 。
某研究性学习小组设计并进行了如下实验。
⑴甲组同学用下图装置制取干燥纯净的二氧化碳。请回答下列问题: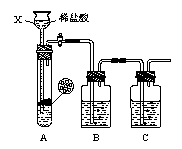
①仪器X的名称是 。实验前,关闭活塞,向X中加入水使X中液面高于试管中液面,一段时间后液面保持不变说明 。
②为除去CO2中的HCl气体,B装置中盛放饱和NaHCO3溶液,请写出该反应的化学方程式 。③要得到干燥的CO2,C装置中应盛放 试剂。
④请说明装置B、C中试剂不能交换的原因: 。
⑵乙组同学围绕CO还原CuO产生的红色固体是否一定是Cu进行如下探究:
【查阅资料】①Cu2O粉末呈红色,在酸性溶液中,Cu2O+H2SO4=Cu+ CuSO4+H2O 。②在空气中高温灼烧时:Cu2O稳定,而CuO将分解生成Cu2O和O2。
【提出猜想】猜想Ⅰ:红色固体是Cu;
猜想Ⅱ:红色固体是Cu2O;
猜想Ⅲ:红色固体是 。
【实验探究】步骤Ⅰ:取一定质量的红色固体在空气中高温灼烧,直到质量不再发生改变,称量得到固体的质量增加。说明红色固体中含有 ,写出由Cu生成Cu2O的化学方程式 。
步骤Ⅱ:取一定质量的红色固体投入稀硫酸中,充分反应后溶液呈蓝色。根据以上现象,得到猜想 正确。
【拓展延伸】通过称量红色固体(a g)及灼烧至质量不变时的质量(b g),可以判断红色固体的成分。则欲得到上述实验探究的结果,a、b之间应满足的关系为:128(b-a)/16 a(选填“>”、“<”或“=”)。
小明同学在家里的药箱中发现一瓶用来清洗伤口用的消毒液——“双氧水”,他联想到在化学课上用过氧化氢溶液制取过氧气,他高兴的将家中的“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验。
【第一组实验】小明欲证明该双氧水是否失效。
(1)实验过程
①在试管中加入5 mL “双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
③如右图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是 。
(2)实验结论:。
【第二组实验】小明欲证明二氧化锰在双氧水的分解反应中起催化作用,该物质在反应前后质量是否发生变化。
(1)实验原理
写出化学反应的文字表达式;
(2)实验步骤
①;
②将二氧化锰装入大试管中并加入5 mL“双氧水”;
③待反应结束后,将大试管里的固体物质进行过滤、洗涤、烘干、称量;
④。
(3)做完此实验后,小方认为要证明二氧化锰的催化作用,还需要再补充一个探究实验:探究。
【实验反思】依据所做的实验,影响化学反应速率的因素可能有等。
【第三组实验】小明利用制得的一瓶氧气,欲验证铁丝能否在氧气中燃烧。
⑴小明先在盛有氧气的集气瓶中加入少量水,目的是;
⑵小明将用砂纸打磨干净的细铁丝绕成螺旋状,并在一端系上一根火柴,在酒精灯火焰上点燃,待火柴即将燃烧完时,伸入集气瓶中,观察到,放出大量热,生成;
⑶实验结论:铁丝能在氧气中燃烧,反应的文字表达式为
有人提出运用高科技可以使水变成汽油,小明认为可以用物质组成的观点揭开这个骗局。以下是小明的实验探究过程。
【提出问题】根据水的组成和汽油的组成判断,水是否可以变成汽油?
【猜想与验证】(1)探究水的组成。实验装置示意图如下:
|
通电一段时间后,经过检验可知,试管1中的气体是 。该反应的化学方程式为
。| 实验步骤 |
实验现象和化学方程式 |
实验目的 |
| ①点燃使用汽油作燃料的油灯 |
 |
 |
| ②将光洁干冷的小烧杯罩在油灯火焰的上方 |
现象: |
证明汽油在空气中燃烧后的产物中有水 |
| ③将内壁蘸有 的小烧杯罩在油灯火焰的上方 |
现象: |
证明汽油在空气中燃烧后的产物中有二氧化碳 |
该实验说明:汽油的组成中肯定含有的元素有 (写元素符号)。
【得出结论】因为汽油和水的组成元素不同,所以水不能变成汽油。
金属材料包括纯金属以及它们的合金,在生产、生活和社会发展中起着非常重要的作用。(1)某校同学以“比较锰、铁、铜3种金属的活动性”为课题进行探究。
提供的药品:铁片、铜片、锰片、稀盐酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锰溶液。
【作出猜想】他们考虑到铁的活动性比铜强,对3种金属的活动性顺序作出如下猜想。
猜想一:;
猜想二:铁>铜>锰;
猜想三:铁>锰>铜。
【设计实验】为了验证猜想成立,同学们分成三组,分别针对一种猜想设计实验方案:
①第一组验证猜想一。实验方案是将锰片、铁片分别放入稀盐酸中,观察现象;
②第二组验证猜想二。实验方案是将锰片放入中,观察现象;
③第三组验证猜想三。实验方案是(只用两个实验):
。
【实验及结论】各组通过实验和交流,确认猜想一是正确的。第一组同学的实验现象是:
。
(2)铜与锌的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某种黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入同一种稀硫酸,并将每次加入稀硫酸的质量和充分反应后剩余固体的质量记录于下表:
| 加入稀硫酸的质量(g) |
充分反应后剩余固体的质量(g) |
|
| 第1次 |
20 |
17.4 |
| 第2次 |
20 |
14.8 |
| 第3次 |
20 |
12.2 |
| 第4次 |
20 |
12.0 |
| 第5次 |
20 |
m |
①表格中m=;
②黄铜样品中锌的质量分数为。