若将反应:Zn+H2SO4= ZnSO4+H2↑设计成原电池(装置如图),则下列说法正确的是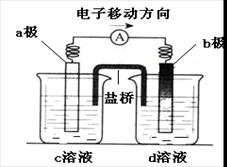
| A.d溶液是稀硫酸 | B.c溶液颜色变蓝 |
| C.b极发生氧化反应 | D.a极是铜棒 |
下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A.将NaHCO3固体加入新制氯水中,有无色气泡产生(H+) |
| B.使红色布条褪色(HCl) |
| C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2) |
| D.滴加AgNO3溶液生成白色沉淀(Cl-) |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。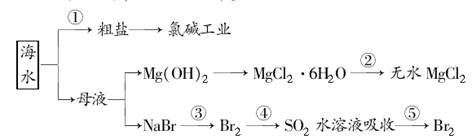
下列有关说法不正确的是( )
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
| D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入化学药品的顺序为:Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸 |
在氯水中存在着如下反应:Cl2+H2O=HCl+HClO,因此氯水中存在多种分子和离子。在下列实验现象中与相应离子或分子性质关系正确的是( )
| A.氯水有刺激性气味说明氯水中有HCl |
| B.氯水中滴入品红溶液,溶液为无色说明氯水中有Cl2 |
| C.向氯水中通入SO2气体,氯水黄绿色褪去说明Cl2发生了反应 |
| D.向氯水中加入CaCO3有气泡产生,说明有HCl和HClO |
氯气与二氧化硫都有漂白作用,若将等物质的量的这两种气体混合后通入品红和BaCl2的混合溶液中,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
| A.①② | B.①③ | C.②③ | D.②④ |
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2。下列关于混盐CaOCl2的有关判断正确的是( )
| A.该混盐中氯元素的化合价为-1 |
| B.该混盐的水溶液呈中性 |
| C.该混盐与盐酸反应产生1 mol Cl2时转移2 mol电子 |
| D.该混盐具有和漂白粉相似的化学性质 |