通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
| |
现象 |
解释 |
| A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
| B |
浓HNO3在光照条件下变黄 |
浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
| C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
| D |
铜片放入浓硫酸中,无明显变化 |
说明铜在冷的浓硫酸中发生钝化 |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):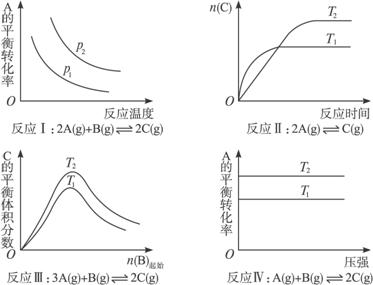
根据以上规律判断,下列结论正确的是( )
| A.反应Ⅰ:ΔH>0,p2>p1 |
| B.反应Ⅱ:ΔH<0,T1>T2 |
| C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1 |
| D.反应Ⅳ:ΔH<0,T2>T1 |
在某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH>0
Z(g)+W(s) ΔH>0
下列叙述正确的是( )
| A.加入少量W,逆反应速率增大 |
| B.当容器中气体压强不变时,反应达到平衡 |
| C.升高温度,平衡逆向移动 |
| D.平衡后加入X,上述反应的ΔH增大 |
反应2A(g)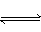 2B(g)+E(g)-Q达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()
2B(g)+E(g)-Q达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()
| A.加压 | B.减压 |
| C.减小E的浓度 | D.降温 |
在一定条件下,可逆反应N2+3H2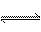 2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
| A.加催化剂,v(正)、v(逆)都发生变化,且变化的倍数相等 |
| B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数 |
| C.降温,v(正)、v(逆)减小,且v(正)减小的倍数大于v(逆)减小的倍数 |
| D.体积不变,加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数 |
如图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )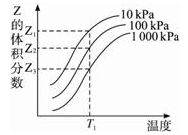
| A.上述可逆反应的正反应为放热反应 |
| B.X、Y、Z均为气体 |
| C.X和Y中只有一种为气态,Z为气态 |
| D.上述反应的逆反应ΔH>0 |