目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
(2)配合物分子内的作用力有 (填编号)。
| A.氢键 | B.离子键 | C.共价键 | D.金属键 E.配位键 |
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
①CH2=CH2、②CH≡CH、③苯、④HCHO等,
其中分子属于平面结构的有 (填物质序号),预测HCHO分子的立体结构为 形。
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为 。
A、B、C、D和甲有以下转化关系。已知物质甲是短周期元素组成的盐,且是某 种消毒液的有效成分,沉淀D可溶于酸。
种消毒液的有效成分,沉淀D可溶于酸。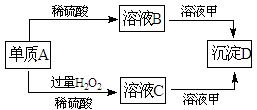
请回答下列问题:
(1)组成A的元素在周期表中位于第周期第族。
(2)鉴定C中阳离子(不考虑H+)的操作和现象是。
(3)A转化为B时会放出无色气体E,在298K时1mol A完全反应放出热量QkJ,则该反应的热化学方程式为。
(4)若A转化为C时无气体放出,写出该反应的化学方程式:
。
(5)写出溶液 C和溶液甲反应的离子方程式:。
C和溶液甲反应的离子方程式:。
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g) 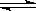 CH3OH(g)。
CH3OH(g)。
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=。
②下列各项中,不能够说明该反应已达到平衡的是______________(填序号)。
a. 恒温、恒容条件下,容器内的压强不发生变化
b. 一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c. 一定条件下,CO、H2和CH3OH的浓度保持不变
d. 一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2)下图是该反应在不同温度下CO的转化率随时间变化的曲线。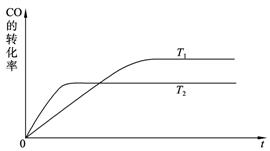
①该反应的焓变ΔH____________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1____________K2(填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
a. 升高温度b. 将CH3OH(g)从体系中分离
c. 使用合适 的催化剂d. 充入He,使体系总压强增大
的催化剂d. 充入He,使体系总压强增大
(3)已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH=-a kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g)ΔH=-b kJ·mol-1
③ H2O(g)= H2O(l)ΔH=-c kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(l)ΔH=______________kJ·mol-1。
(4) 2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。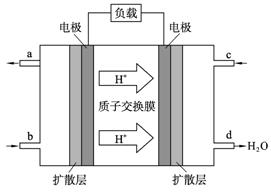
①该电池工作时,b口通入的物质为____________, c口通入的物质为__________。
②该电池正极的电极反应式为:_______________________________。
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。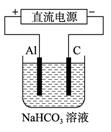
(5)以上述电池做电源,用上图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
_______________________________________________________,
_______________________________________________________。
下图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲是发酵粉的主要成分,乙是一种常用的化肥。B、D常温常压下是气体。请回答下列问题: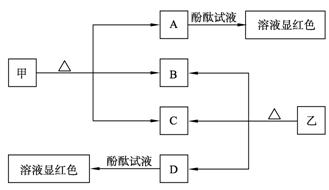
(1)甲的俗名是____________________ ________。
________。
(2) A、D物质的水溶液分别滴入酚酞试液后,溶液均显红 色,说明溶液均显性,其原理是否相同?请用必要的文字加以解释并写出离子方程式:
色,说明溶液均显性,其原理是否相同?请用必要的文字加以解释并写出离子方程式:
__________________________________________________________。
(3)向饱和氯化钠溶液中通入气体D至饱和后,再通入足量的气体B可制得物质甲,写出该反应的化学方程式:__________________________________________。
A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;
D与A同主族,且与E同周期;E 元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1) X的化学式为______,D的原子结构示意图为______。
(2)元素的非金属性C______E(填“>”、“<”或“=”),下列各项中,能说明这一结论的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ) NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2==NaBC2+NaBC+H2O
NaOH溶液与BC气体不反应
a. 装置①、②、③中盛放的药品依次是______、______、______。
b. 通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
c. 能够说明实验已成功的现象是___________________________。
肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,其结构和性质如下表所示:
| 结构 |
分子中只含有一个苯环,苯环上只有一个取代基且无支链,且取代基上含有碳碳双键 |
| 性质 |
 ①能使溴水因发生化学反应而褪色 ①能使溴水因发生化学反应而褪色②在NaOH溶液中易发生水解反应生成具有剧毒的醇类物质 |
试回答下列问题:
(1)肉桂酸甲酯的结构简式为。
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构 模型如右图所示(图中球与球之间的连线表示单键或双键)。
模型如右图所示(图中球与球之间的连线表示单键或双键)。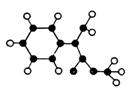
用芳香烃A为原料合成G的路线如下: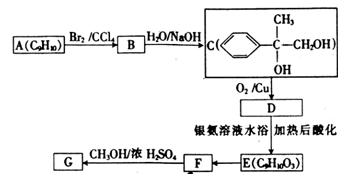
①化合物E中的官能团有(填名称)。
②A→B的反应类型是, E→F的反应类型是。
E→F的反应类型是。
③写出下列反应的化学方程式:
C→D:;
F→G:;
④E有多种同分异构体,其中有一类可用通式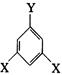 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的其中两种物质的结构简式:
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的其中两种物质的结构简式:
。