强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是( )
| A.⊿H1>⊿H2>⊿H3 | B.⊿H1<⊿H3<⊿H2 |
| C.⊿H1<⊿H2<⊿H3 | D.⊿H1>⊿H3>⊿H2 |
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确是
| A.阳极反应为Fe-2e- =Fe2+ |
| B.电解过程中溶液pH不会变化 |
| C.过程中有Fe(OH)3沉淀生成 |
| D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原 |
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3) kJ/mol |
| B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)===CO2 (g);△H=-283.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热 |
已知:2H2(g)+O2(g)=2H2O(g);ΔH=-270kJ·mol-1,下列说法错误的是
| A.2mol水蒸气分解成2mol氢气与1mol氧气吸收270kJ热量 |
| B.2mol氢气与1mol氧气反应生成2mol液态水放出热量大于270kJ |
| C.在相同条件下,2mol氢气与1mol氧气的能量总和大于2mol水蒸汽的能量 |
| D.2个氢气分子与1个氧气分子反应生成2个水蒸汽分子放出270kJ热量 |
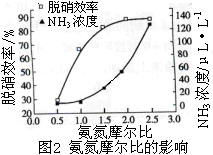
使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)+O2(g) 4N2+6H2O(g),下图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果。下列说法正确的是
4N2+6H2O(g),下图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果。下列说法正确的是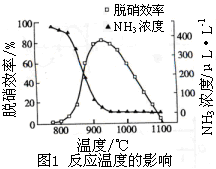
| A.从图1判断,该反应的正反应方向是放热反应 |
| B.从图1判断,脱硝的最佳温度约为925℃ |
| C.从图2判断,减少氨气的浓度有助于提高NO的转化率 |
| D.从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5 |