(14分)化学上常用燃烧法确定有机物的组成.下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成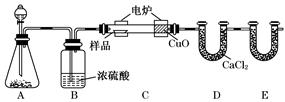
回答下列问题:
(1)A装置中分液漏斗盛放的物质是______________,写出有关反应的化学方程式______________________________________________________________.
(2)C装置(燃烧管)中CuO的作用是______________________________________
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________.
(4)若将B装置去掉会对实验造成什么影响? __________________________.
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为____.
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1) 烧瓶底部放置了几片碎瓷片,
碎瓷片的作用是 。
装置B中发生反应的化学方程式是____________________________ ____。
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,装置E中的现象是_ 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。
简述检验滤液中Fe3+的操作方法____________________________。
(4) 该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
步骤I中通入Cl2的作用是________________________________。
研究性学习小组探究金属锈蚀的条件,进行如下对照实验:
(1)数天后铁钉明显锈蚀的装置是 ;
(2)铁制品锈蚀的条件是 ;
(3)铁钉生锈主要属于 腐蚀(填“化学”或“电化学”);
化学小组同学依据化学反应Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与110 mL 98%的浓H2SO4充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。(F中为无水硫酸铜)
ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与110 mL 98%的浓H2SO4充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。(F中为无水硫酸铜)
请回答下列问题:
(1)装置A中添加液体的仪器名称为 ; 98%的浓H2SO4(ρ=1.84 g/cm3)的物质的量浓度是 ;
(2)装置B是为了吸收SO2,则不能选用下列试剂中的 (填序号);
A.NaOH溶液 B.浓H2SO4 C.KMnO4溶液
(3)装置D的作用是 ;
(4)可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有氢气的实验现象是 。
(1)用天平称取________g NaOH配制500 mL 2.0 mol·L-1的溶液时,除了烧杯、玻璃棒外,还要使用的玻璃仪器是 。
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是 。
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用图9所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白:
(1)烧瓶a要求温度迅速升高到170℃发生反应,写出该反应的化学方程式 ;该反应类型为 。
(2)写出制备1,2-二溴乙烷的化学方程式 。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象 。
(4)容器c中NaOH溶液的作用是 ;e装置内NaOH溶液的作用是 。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(至少2点) 、 。