下面列出了几组物质,请将物质的合适组号填写在空格上。⑴同位素 ,⑵同素异形体__________;⑶同系物 ,⑷同分异构体 。
①金刚石与“足球烯”C60; ②D与T; ③16O、17O和18O;
④氧气(O2)与臭氧(O3); ⑤CH4和CH3CH2CH3;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3); ⑦
⑦ 和
和 ; ⑧ 和
; ⑧ 和 ;
;
国际化学年的中国宣传口号是“化学-----我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
①若金属钠等活泼金属着火时,应该用 来灭火。
②经火焰灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)的元素是 。
③胃舒平(含有氢氧化铝)可治疗胃酸过多,其反应的离子反应方程式为: 。
④明矾能净水,其电离方程式是 。
用于分离或提纯物质的方法有:
A蒸馏(分馏) B萃取 C过滤 D重结晶 E分液。
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒 。
(2)分离四氯化碳与水的混合物 。
(3)分离汽油和煤油 。
(4)分离碘水中的碘单质 。
(5)提纯氯化钠和硝酸钾混合物中的硝酸钾 。
在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 , (答两种);
(3)为了进一步研究上述反应中硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下6组实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实 验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1H2SO4 / mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液 / mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O / mL |
V7 |
V8 |
V9 |
15 |
10 |
0 |
请完成此实验设计,其中:其中:V2 V5(填“>”、“<”或“=”);
V5= , V6= ,V8= ;(填具体数值)
化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图实验(图中所用电极均为惰性电极)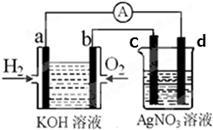
(1)电极a为 极(填“正”或“负”),溶液中OH-移向 极(填a或b);
(2)电极b处所发生的电极反应方程式为 ;[随着反应的进行,氢氧燃料电池内部溶液的PH将 (填“增大”或“减小”);
(3)c极为 (填“阴”或“阳”)极,d电极反应式为 ;
(4)右图装置中盛有100mL0.1mol·L-1AgNO3溶液,当装置工作时右装置中发生的总反应方程式为 ;
(5)当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时右图装置中溶液的c(H+)= 。(溶液体积变化忽略不计)
(6)氢氧燃料电池的优点 ;
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.
Ⅰ.目前工业上有一种方法是用CO2与H2来生产燃料甲醇.一定条件下发生反应:
CO2(g)+3H2(g)⇌ CH3OH(g)+ H2O(g),图1表示该反应过程中能量变化: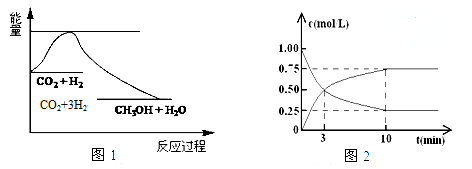
(1)关于该反应的下列说法中,正确的是 (填字母).
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)= .
②H 2的平衡转化率为 .
③下列措施中能使化学平衡向正反应方向移动的是 (填字母).
A.升高温度B.将CH3OH(g)及时液化抽出 C.选择高效催化剂
Ⅱ. 在一定体积的密闭容器中,进行如下化学反应CO2(g)+H2(g)  CO(g)+H2O(g),,其中化学平衡常数K和温度的关系如下表:
CO(g)+H2O(g),,其中化学平衡常数K和温度的关系如下表:
| t/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1)该反应的平衡常数表达式K= 此反应为 反应(填“放热”或“吸热”)
(2)在830℃下,在10L容器中含有1molCO2、 1.2molH2、 0.75molCO、 1.5molH2O,则此时反应v(N2)正________ v(N2)逆(填“>”、“<”、“=”),对此反应状态的描述正确的为 (填下列序号)
A.恰好处于平衡状态 B.向正反应方向进行 C.向逆反应方向进行