“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题: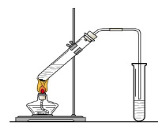
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中按一定比例将乙醇、乙酸混合后充分加热,在右边小试管中未收集到有香味的液体(气密性良好),原因可能是:
。
(3)右边小试管中应先加入的试剂是:① ;②其作用是 。
(4)若乙酸中的氧元素都用18O 标识,充分反应,在反应体系中含有18O 的物质共有 种。
(5)下列描述能说明乙醇与乙酸的酯化反应已达到该反应的限度的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。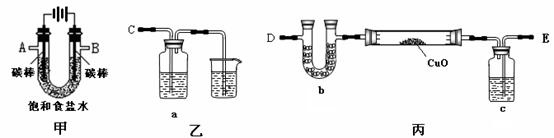
(1)为完成上述实验,正确的连接顺序为A连_______;B连_______(填写连接的字母)。
(2)对硬质玻璃管里的氧化铜 粉末加热前,需要的操作为________________。
粉末加热前,需要的操作为________________。
(3)若检验 氯气的氧化性,则乙装置的a瓶中溶液可以是_____________,对应的现象为___________________________________________________。
氯气的氧化性,则乙装置的a瓶中溶液可以是_____________,对应的现象为___________________________________________________。
(4)丙装置的c瓶中盛放的试剂为 _____________,作用是____________________。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g,实验完毕后
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g, 进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:________方案测得结果更准确。你认为不合理的方案的不足之处在________________________________。
②按测得结果更准确的方案进行计算,Cu的相对原子质量___________________。
某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将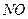 氧化成
氧化成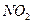 ,而稀硝酸不能氧化
,而稀硝酸不能氧化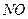 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。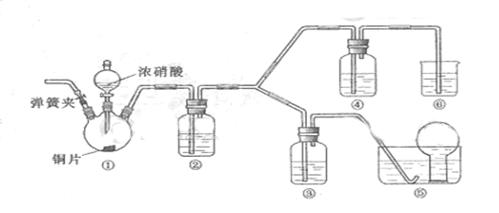
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与 反应,能与
反应,能与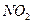 反应
反应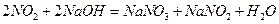
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
、、
(2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后鼓入过量CO2的目的是
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是,发生反应的化学方程式是
(5)该小组得出的结论依据的试验现象是
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法哪种正确 这些方案中可行的是(选填序号字母)
这些方案中可行的是(选填序号字母)
a. 加热该绿色溶液,观察颜色变化
b. 加水稀释绿色溶液,观察颜色变化
c. 向该绿色溶液中通入氮气,观察颜色变化
d. 向硝酸铜溶液中加入硝酸铜固体至饱和;同时向硝酸铜溶液中通入浓硝酸与铜反应
产生的气体,对比观察颜色变化
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。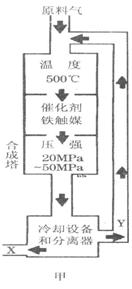

①X的化学式为__________,属于________(填“极性”或“非极性”)分子。 ②图甲中条件选定的主要原因是(选填字母序号,下同)________。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应:
___________________________________________________________________。
②氨水中水电离出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③将氨水和盐酸混合后, 某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一种溶质,该溶质的名称是,上述离子浓度大小顺序关系中正确的是(选填序号)。
Ⅱ、若上述关系中C是正确的,则溶液中溶质的化学式是。
Ⅲ、若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl)c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)c(Cl-)。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成X和Y两种物质。X为铵盐,Y在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol X。
①写出氨气和氟气反应的化学方程式: ___________________________________。
②在标准状况下,每生成1 mol Y,转移电子的物质的量为___________mol。
(4)已知液态NH3与H2O相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则液态NH3的电离方程式为:
镁在空气中燃烧除生成MgO外,还可能生成Mg3N2。某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成。
(1)甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色石蕊试纸变蓝 的气体,该气体的化学式为,说明固体中含有Mg3N2,生成该气体的化学反应方程式为。
(2)乙组同学为测定Mg3N2含量,用图示装置进行实验,充分反应后再加热A。其中浓硫酸的作用是,对A加热的目的是 。已知加入的固体质量为4.0g,最终C装置增重ag,则固体中含Mg3N2g(用含a的式子表示)。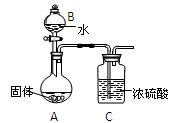
(3)丙组有的同学认为乙组同学的测定结果偏高,理由是
。
有的同学认为乙组同学的测定结果偏低,理由是
。
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并
灼烧固体至恒重,测得其质量为4.08g。上述过程中,洗涤沉淀的操作是
。
镁在空气中燃烧后生成的固体中Mg3N2的质量分数为。
(4)有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成 本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与 铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨。写出用固体(NH4)2SO4与含镁矿石粉煅烧的化学反应方程式
。
有机化合物A的相对分子质量为153,A有如下的性质:
Ⅰ.取A的溶液少许,加入NaHCO3溶液,有气体放出。
Ⅱ.另取A的溶液,向其中加入足量的NaOH溶液,加热反应一段时间后,再加入过量的
HNO3酸化的AgNO3溶液,有淡黄色沉淀生成。
A有如下的转化: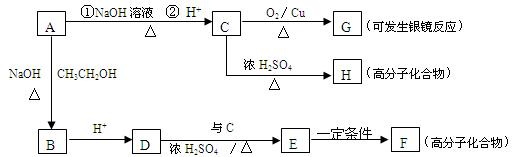
请填空:
(1)A物质的结构简式。
(2)C→G的反应类型;A→B的反应类型。
(3)写出与C具有相同官能团的同分异构体的结构简式;
G与过量的银氨溶液反应,每生成2.16克Ag,消耗G的物质的量是mol。
(4)写出下列反应的化学方程式:
D→E。
C→H。