把0.4molX气体和0.6molY气体混合于2L密闭容器中,一定条件下使它们发生如下反应:
2X(g)+Y(g) nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min
nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min
(1)达到平衡时X的浓度为_________________
(2)化学方程式中的n值是_____________________;
在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应: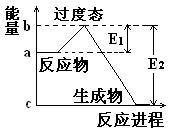
NO2+CO 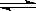 CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:
(1)此段时间内,用CO2表示的平均反应速率为 。
(2)2 min时,CO 的转化率为。
(3)假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量(填“大于”、“小于”或“等于”)开始时容器内气体的总物质的量。
工业上用含80% FeS2的硫铁矿制取硫代硫酸钠,涉及到的化学反应如下(杂质不与O2、盐酸反应):
4FeS2+11O2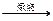 2Fe2O3+8SO2①
2Fe2O3+8SO2①
FeS2+2HCl→ FeCl2+H2S↑+S↓②
2H2S+SO2→ 3S+2H2O③
2NaOH+SO2→Na2SO3+H2O④
Na2SO3+S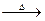 Na2S2O3⑤
Na2S2O3⑤
通过分析上述反应,进行计算:
(1)若在某密闭容器中加入150 g上述硫铁矿,并通入10 mol含氧气体积分数为0.4的富氧空气,按反应①充分反应后得到的气体中SO2的体积分数为__________(计算结果保留3位小数)。
(2)若以上各步反应的转化率均为100%,则150 g上述硫铁矿理论上最多可制得Na2S2O3___ g。
(3)若NaOH溶液吸收SO2的吸收率为90%,其它反应的转化率均为100%,则150 g上述硫铁矿最多可制得Na2S2O3多少g(写出计算过程,计算结果保留1位小数)?
(4)若反应②、④的转化率为90%,其它反应的转化率均为100%,要制得Na2S2O3最多,则原料中FeS2在反应①和②中的理论质量配比为多少(写出计算过程,计算结果保留3位小数)?
取m克铁粉与1 L 1.2 mol/L的稀HNO3恰好完全反应,反应后的溶液中只含Fe2+且硝酸的还原产物只有NO。则:
(1)m=g。
(2)若将反应后的溶液低温蒸干,析出晶体135 g,则析出晶体的组成可能是。
(3)若向反应后的溶液中加入100 mL 1.5 mol/L的稀H2SO4,则标准状态下还能产生NO的体积为______L。
根据烷、烯、炔烃燃烧的反应方程式,有人总结出以下规律:对于烷烃有n(烷烃)=n(H2O)-n(CO2),对于烯烃有n(H2O)-n(CO2)=0,对于炔烃有n(炔烃)=n(CO2)-n(H2O)。请回答下列问题:
(1)某混合气体由C2H6和C3H4组成。将1.0L混合气在氧气中充分燃烧,产生的CO2体积比水蒸气多0.2L(相同状况下测定),通过计算确定C2H6的体积。(请写出计算过程)
(2)某混合气由烯烃和烷烃或烯烃和炔烃组成。组成中可能是两种气体,也可能是多种气体。将1.0L混合气在氧气中充分燃烧,产生3.0LCO2和2.4L水蒸气(相同状况下测定)。试判断混合气是由烯烃和▲两类烃组成,其体积比为___▲_____。
进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡。
(1)25℃时,已知胃液的pH在0.9—1.5之间,请问___(填“能”或“不能”)用
碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由:_
。
(2)当人体中Ba2+浓度达到2×10-3mol·L-1时,就会对健康产生危害,若误将氯化钡当做食盐使用,请计算说明是否可以通过服用5%的硫酸钠溶液(约0.36mol·L-1)有效除去胃中的Ba2+。(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
。 (3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
(3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
① Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;② I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。