下列说法正确的是( )
| A.某有机物燃烧只生成CO2和H2O,且二者的物质的量相等,则此有机物的组成为CnH2n |
| B.相同质量的烃,完全燃烧,烃中碳的百分含量越高,消耗O2越少 |
| C.某气态 CxH4若与足量O2完全反应,则反应前后气体体积不变 |
| D.烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积 |
下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+ H2O  HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 |
B.对CO(g) + NO2 (g) CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深 CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深 |
| C.升高温度能够增大硝酸钾在水中的溶解度 |
| D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
反应:A(g)+3B(g) 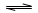 2C(g) △H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是
2C(g) △H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是
一定温度下,可逆反应2NO2 = 2NO+O2在容积固定的密闭容器中反应,达到平衡时的标志是
①单位时间内生成nmolO2,同时生成2nmolNO2②单位时间内生成nmolO2,同时生成2nmolNO③用NO2、NO、O2的物质的量浓度变化表示的反应速率为2:2:1④混合气体的压强不再变化⑤混合气体的颜色不再变化⑥混合气体的平均分子量不再改变
| A.①④⑤⑥ | B.①②③⑤ | C.②③④⑥ | D.以上全部 |
下列说法或表示方法中正确的是
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(金刚石)→C(石墨)ΔH=" -1.9KJ/mol" 可知,金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ |
电子表和电子计算机的电源通常用微型银-锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液总反应式:Ag2O + H2O+ Zn=Zn(OH)2 + 2Ag 下列说法正确的是
| A.Ag2O是正极, Zn是负极 |
| B.Zn是正极,Ag2O是负极 |
| C.工作时,电池负极区溶液PH增大 |
| D.工作时,电子由Ag2O极经外电路流向Zn极 |