实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,
其目的是_________________________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是 。
(3)生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明该反应已达到化学平衡状态的是(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等 ⑤混合物中各物质的浓度不再变化
(4)(每空1分)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
E为____________(填名称);试剂a是__________,试剂b为_______;分离方法①是___________,分离方法②是__________________,分离方法③是__________。
(5)写出C → D 反应的化学方程式 。
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%-103.0%)的主要流程如下: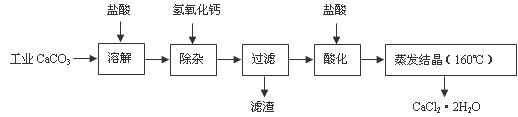
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0-8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的试验操作是 _________________________________________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①________________;②_______________________
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①计算上述样品中CaCl2·2H2O的质量分数为__________________。
②若用上述办法测定的样品中CaCl2·2H2O的质量分数有时超过100.0%(测定过程中产生的误差可忽略),其可能原因有_____________________________。
某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示:
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取7.5mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)步骤①中,配制100 mL 1.0 mol/L的盐酸溶液时,下列哪些操作会使配制浓度偏小(填写字母)____。
A 用量筒量取浓盐酸时,俯视量筒的刻度 B容量瓶未干燥即用来配制溶液
C浓盐酸在烧杯中稀释时,搅拌时间过长
| A.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线 E.在容量瓶中定容时俯视容量瓶刻度线 F.烧杯中有少量水 (2)请填写操作步骤中的空格:步骤②_______________ 步骤③___________ (3)实验步骤⑤中应选用__________(填字母)的量筒。 |
||
| B.100 mL | C.200 mL | D.500 mL |
(4)读数时除恢复到室温外,还要注意①______________,②_____________________。
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=____L/mol。
某小组同学在制备氢氧化铜时,将20 mL 2 mol/L的NaOH溶液滴入50 mL 1 mol/L的CuSO4溶液中,得到了绿色沉淀.这与“氢氧化铜是蓝色沉淀”这一文献说法不符,为探究该绿色沉淀的成分,他们做了如下实验进行探究.。
[实验一]
将20 mL 1 mol/L的CuSO4溶液滴入50 mL 2 mol/L的NaOH溶液中,观察到生成了蓝色沉淀.
[实验二]
①将绿色沉淀过滤、洗涤、低温烘干.
②称取2.58 g该绿色沉淀,投入50 mL 2 mol/L的NaOH溶液中,剧烈振荡,沉淀变成蓝色,过滤、洗涤,并将洗涤液转移到滤液中,低温烘干称量得蓝色沉淀为1.96 g.
③向②的滤液中加入足量氯化钡溶液,有白色沉淀生成,过滤、洗涤、烘干后称量为2.33 g.
请回答下列问题:
(1)配制220ml 1mol/L的硫酸铜溶液除需用托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是,在实验中需称量胆矾克
(2)该组同学做实验一的目的或作用是
(3)实验二中第①步洗涤沉淀的方法是
(4)通过计算,该绿色沉淀的成分可表示为 .
(5)写出实验二中第②步发生反应的离子方程式:
(10分)聚合硫酸铁(SPFS)是一种新型的饮用水处理剂和城市污水净化剂,其化学组成可表示为[Fe2(OH)n(SO4)3 - 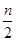 ]m 。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
]m 。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
试剂:1.0 mol·L-1的盐酸、1.0 mol·L-1的KMnO4溶液、 0.1 mol·L-1的BaCl2溶液、20%的KSCN溶液、品红溶液、蒸馏水、冰水。
(1)聚合硫酸铁中铁元素的化合价是________
(2)固体产物成分的探究
【实验设计】
| 实验步骤 |
现象 |
| 步骤1:取适量的固体产物于试管中,加入足量1.0 mol·L-1的盐酸,充分振荡使固体完全溶解。 |
固体溶解,没有观察 到气泡,溶液呈黄色 |
| 步骤2:取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液振荡 |
溶液呈血红色 |
| 步骤3:另取少量步骤1所得溶液于试管中,滴入少量1.0 mol·L-1的KMnO4溶液,振荡。 |
KMnO4的紫红色不褪去 |
【思考与判断】根据上面的信息,可以确定固体产物的成分是________;
步骤1中发生反应的离子方程式为
(3)气体产物成分的探究(不考虑水蒸气)
【提出假设】假设1:所得气体的成分是SO3假设2:所得气体的成分是SO2、O2
假设3:所得气体的成分是
【设计实验方案,验证假设】按下表的实验步骤写出预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1:将少量气体产物通入盛有适量品红溶液的试管中,观察溶液的颜色变化,然后加热再观察溶液的颜色变化 |
① ② |
| 步骤2:将气体产物缓缓通过浸在冰水中的U形管(如图),然后在U形管中加入适量0.1 mol·L-1的BaCl2溶液,充分振荡 |
结合步骤1中的② |
胆矾晶体是硫酸铜的结晶水合物,其化学式为CuSO4•5H2O。在加热情况下,按温度不同,胆矾晶体会历经一系列的变化,得到不同组成的固体。(第(1)(2)问用小数表示)
(1)称取0.10g含有杂质的胆矾试样于锥形瓶中,加入0.10 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.10 mol/L硫酸滴定到终点,消耗硫酸10.08 mL,则试样中胆矾的质量分数为________(已知:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4;试样中杂质不与酸碱反应)
(2)将1.250 g纯净的胆矾晶体置于坩埚中加热一段时间,测得剩余固体质量为0.960 g。剩余固体中结晶水的质量分数为__________(保留三位小数)。
(3)将无水硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体。现将9.600 g无水硫酸铜充分加热分解为氧化铜,将生成的气体通过足量的吸收剂(碱石灰),吸收剂增重4.416 g。则最终吸收剂中硫酸盐与亚硫酸盐的物质的量之比为
(4)取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于