某研究小组制得一种有机物F,是一种新型镇痛和麻醉药物,可通过以下路线合成得到,线路如下:
已知信息:
(1)有机物D、E不能使FeCl3显紫色,有机物B的结构片断为 
(2)
(3)
请回答下列问题:
(1)F分子式为 ,A中官能团为(任写一种)_______。
(2)反应②类型_________________.
(3)B的结构简式为 。
(4)X是A的同分异构体,X的结构具有以下特征:①属于芳香族化合物;②属于酯类;③可以发生银镜反应。符合条件的X所有同分异构体有_________种。
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作4次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) |
待测盐酸溶液的体积(mL) |
| 1 |
0.10 |
20.02 |
20.00 |
| 2 |
0.10 |
20.00 |
20.00 |
| 3 |
0.10 |
19.00 |
20.00 |
| 4 |
0.10 |
19.98 |
20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为__________g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有_________________________________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是________________。滴定达到终点的现象是_______________________________________。
(3)根据上述数据,可计算出该盐酸的浓度为。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有
A. 配制标准溶液定容时,加水超过刻度
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
(13分)过氧化钠(化学式为NaNa2O2)可用在呼吸面具中作为氧气来源。Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示);它也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O = 4NaOH+O2↑。以下是某兴趣小组进行的探究活动。
(1)利用如下图所示实验装置制取氧气,请回答有关问题。
①实验室制取CO2的化学方程式为。
②表明CO2未被Na2O2完全吸收的实验现象为。
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的性质。
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验。
①有同学猜想X可能是酸、碱或盐中的一种。通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是。
②同学们通过讨论和实验证明了X是Na2CO3。以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整。
| 实验操作 |
现象 |
有关的化学方程式 |
| 实验一:取少量固体样品, |
澄清石灰水变浑浊 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的溶液 |
有白色沉淀产生 |
(3)7.8g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数。
(5分)右图是实验室常用的制取气体的装置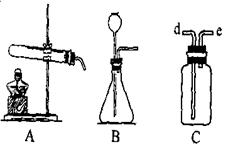
(1)采用B装置制取氧气时化学方程式:
(2)C装置用途很多,可用来洗气。如要除去O2中少量的CO2可用到此装置,此时瓶中盛(填化学式)溶液,导管由进出(填d或e,下同);用排空气法收集氢气(瓶中为空气),导管由进出。
FeSO4•7H2O广泛用于医药和工业领域。
以下是FeSO4•7H2O的实验室制备流程图。根据题意完成下列填空: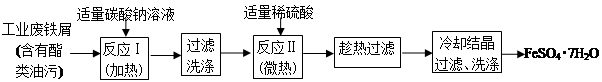
(1)碳酸钠溶液能除去酯类油污,是因为 (用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是 。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是(用离子方程式回答) , 。
(3)判断反应Ⅱ完成的现象是: , 。
以下是测定某补血剂(FeSO4•7H2O)中铁元素含量的流程图。根据题意完成下列填空:
|
 (4)、步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。写出步骤Ⅳ的离子方程式: 。
(4)、步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。写出步骤Ⅳ的离子方程式: 。
(15分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。
回答下列问题:
(1)A中加入的物质是______________,发生反应的化学方程式是_____________。
(2)B中加入的物质是________,其作用是。
(3)实验时在C中观察到的现象是__________________________,发生反应的化学方程式是____________________。
(4)实验时在D中观察到的现象是________,D中收集到的物质是________,检验该物质的方法和现象是________________________。