(13分)过氧化钠(化学式为NaNa2O2)可用在呼吸面具中作为氧气来源。Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示);它也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O = 4NaOH+O2↑。以下是某兴趣小组进行的探究活动。
(1)利用如下图所示实验装置制取氧气,请回答有关问题。
①实验室制取CO2的化学方程式为 。
②表明CO2未被Na2O2完全吸收的实验现象为 。
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的 性质。
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验。
①有同学猜想X可能是酸、碱或盐中的一种。通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是 。
②同学们通过讨论和实验证明了X是Na2CO3。以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整。
| 实验操作 |
现 象 |
有关的化学方程式 |
| 实验一:取少量固体样品, |
澄清石灰水变浑浊 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的 溶液 |
有白色沉淀产生 |
|
(3)7.8g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数。
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有下列哪些试剂的洗气瓶()
| A.澄清石灰水,浓H2SO4 | B.酸性KMnO4,浓H2SO4 |
| C.溴水,浓H2SO4 | D.浓H2SO4,溴水 |
【化学——化学与技术】
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。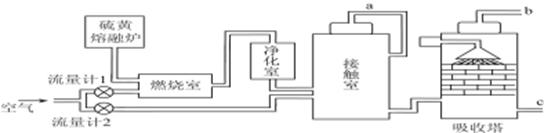
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是__________________________。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为________。(空气中氧气的体积分数按0.2计),该尾气的处理方法是____________________________________________。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是________。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面________(可多选)。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式__________________________________________、______________________________、___________________________________________。
(14分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为。
(3)精制过程要除去SO42-,可选择下列溶液中的(填字母序号)
a. Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、、(填操作名称)而制得50%的NaOH溶液。
(6)写出电解饱和食盐水的离子方程式:
黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准碘溶液20.00mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是;标准碘溶液应盛放在(填“碱式”或“酸式”)滴定管中。
(2)装置a的作用是
(填序号)。
| A.除去空气中的二氧化碳 | B.除去空气中的水蒸气 |
| C.有利于气体混合 | D.有利于观察、控制空气流速 |
(3)若去掉c装置,会使测定结果(填“偏低”、“偏高”或“无影响”),写出影响测定结果的化学方程式:。
(4)上述反应结束后,仍需通一段时间的空气,其目的是。
(5)通过计算可知,该黄铜矿的纯度为。
氢溴酸在工业和医药领域中有着广泛的用途,下图是某兴趣小组模拟工厂制备氢溴酸粗品并精制的流程如下:
(1)混合①使用冰水的目的是;
(2)操作II和III的名称是,;
(3)混合②中发生反应的离子方程式为;
(4)工业上用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂(填化学式)后控制溶液的PH约为8.0即可除去杂质,控制溶液的PH约为8.0的目的是_______________________________________________________;
(5)t℃时,将HBr通入AgNO3溶液中生成的AgBr在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgCl的Ksp=4×l0-10,下列说法不正确的是 ()
| A.向含有Cl-和Br- 的混合液中滴加硝酸银溶液,一定先产生AgBr的沉淀 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ≈816 AgBr(s)+Cl-(aq)平衡常数Κ≈816 |