已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如上图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):

| |
实验前 |
实验后 |
| (干燥剂+U形管)的质量 |
101.1 g |
102.9 g |
| (石灰水+广口瓶)的质量 |
312.0 g |
314.2 g |
根据实验数据完成下列问题:
(1)实验完毕后,生成物中水的质量为_______________g,假设广口瓶里生成一种正盐,其质量为_______________ g。
(2)生成的水中氢元素的质量为_______________ g。
(3)生成的二氧化碳中碳元素的质量为_______________ g。
(4)该燃料中碳元素与氢元素的质量比为_______________。
(5)已知这种燃料的每个分子中只能含有一个氧原子,则该燃料的分子式为______________,结构简式为_______________。
(15分)二氧化硫是大气污染物之一,为粗略测定周围环境中二氧化硫的含量,某课外活动小组的甲、乙两位同学分别用相同实验装置和溶液,测定同一时间,同一地点空气(含SO2、N2、O2气体,其他气体忽略)中SO2的含量。实验装置如右图反应试管中装有碘的淀粉稀溶液A。 SO2和I2发生反应为:S02+I2+2H20=H2SO4+2HI(N2、02不与I2、淀粉反应),试回答下列问题: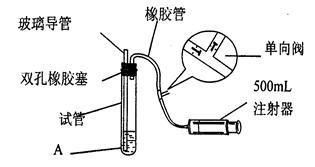
(1)检查该装置气密性时,先在试管中装入适量的水(保证玻璃管的下端浸在水中),然后_____________________(注意阀的单向性),则证明该装置的气密性良好。
(2)若A溶液的体积为VmL,浓度为c mol·L-1,当溶液的颜色刚好变色,停止抽气,此时甲、乙两位同学注射器内抽得气体的体积分别为V甲mL、V乙mL(所有的体积已折算成标况下体积),且V甲>V乙,则甲、乙两个测定结果中与该地点空气中S02的体积分数真实情况最接近的是_______________________(.用含c、V、V甲或V乙…等的关系式表示)。另一位实验结果产生较大误差的原因可能是_______________________________________________
(3)若将上述装置进行改进,除导管外,重新连接装置需要选用的仪器有___________________。 (选下列仪器的编号)
a、烧杯 b、试管 c、锥形瓶 d、容量瓶e、量筒 f、单孔塞 g.双孔塞
(4)欲净化空气,除去空气中的二氧化硫可选用的试剂是___________________。
(7分)试回答下列(1)、 (2)两小题
(1)白磷的着火点为40℃,在室温或夏天正常取出时,就可观察到其被氧化而冒”白烟”,请简单说明将如何将大块的白磷切变成小块的白磷。
(2)某学生在实验报告中写出以下的实验操作或实验数据,你认为合理的是 (填代号A、B……)
A.用托盘天平称取29.25g的食盐;
B.将浓硫酸沿容器器壁缓缓地倒入酒精中,并不断搅拌;
C.用酸式滴定管量取已知浓度的KMn04溶液20.00mL;
D.用湿润的pH试纸测得某溶液的pH为10
E.做中和滴定实验时,锥形瓶用待测液润洗
实验室可通过多条途径得到氮气,常见的三种方法是:
方法一:将氨气通过灼热的氧化铜粉末,得到纯净的氮气和铜。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,逸出氮气。
下列是进行实验时可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、
酒精灯等未列出):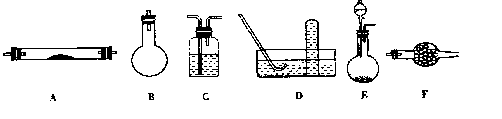
请回答下列问题:
(1)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号)
_________作发生装置,该反应的化学方程式_________________________。
要制取并收集纯净的氮气(可含有少量的水),还应使用上述仪器中的(填仪器的编号,
并按气流方向从左向右列出)_______________________________________________。
(2)制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。
这两种方法与方法三相比,其优越性在于①__________________________________,
②_________________________________________。(至少写两点)
用装置A、B和乳胶管组成装置,用于收集干燥的NH3气体(①装置A已经气密性检查;②可供选用的试剂有碱石灰、水和酚酞)。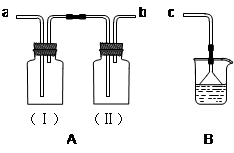
回答下列问题:
⑴气体流经装置的顺序是:NH3→______→_______→c(填接口代号);
⑵干燥剂碱石灰应放在________中(填广口瓶代号);
⑶说明NH3气体已经集满的现象是___________________________________。
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤①、③中研磨固体所用仪器的名称是___________________;
⑵步骤③中洗涤沉淀的操作是______________________________________________
__________________________________________________________。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
| 实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
| ④ |
1.2 g |
无其他物质 |
|
| ⑤ |
1.2 g |
CuO 0.5 g |
|
| ⑥ |
1.2 g |
MnO2 0.5 g |
回答下列问题:
⑶上述实验中的“待测数据”指_____________;
⑷本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
⑸若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,__________________________________________
____________________________________________________;
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a._______________________________,b.CuO的化学性质有没有改变。