人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+离子,不经处理排放危害极大。某工厂技术人员设计了创新方案,使有害离子的浓度降低到排放标准,同时得到了纯度较高的镍粉。
废液经分析组成如下:
在强酸性的废液中加入NaOH调节pH到2,在搅拌下加入饱和Na2CO3溶液和NaClO除去Mn2+、Co2+,并控制pH不超过3.5(Na2CO3需缓慢加入,防止产生大量CO2而冒槽),过滤后电解含Ni2+的过滤液,以镍铬钛不锈钢片为阴极,以铅片为阳极,电解后在阴极得到镍粉。回答下列问题
⑴ 调节强酸性废液至pH=2,可否直接用饱和Na2CO3溶液?分析你的原因
⑵ 写出除去废液中Mn2+、Co2+的反应方程式
⑶ 搅拌过程中Ni不被沉淀下来,实际操作中是如何实现?
⑷ 电解过程中电流效率与pH的关系如下图,试分析如下图所示变化的原因.并选择电解的最佳pH值
(14分,每空2分)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。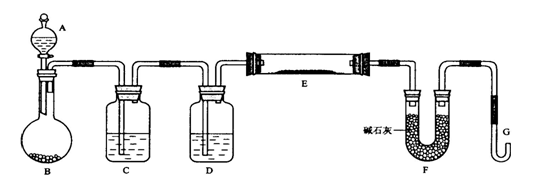
请回答下列问题。
(1)仪器中装入的试剂:C________、 D________;
(2)连接好装置后应首先____________________;
(3)“加热反应管E(用“H”表示)”和“从A瓶逐滴滴加液体(用“I”表示)”这两步操作应该先进行的是(用“H”或“I”表示)_____________。在这两步之间还应进行的操作是_____________________;
(4)从实验中测得了下列数据
①空E管的质量a②E管和WO3的总质量b
③反应后E管和W粉的总质量c(充分反应后冷却到室温称量)
④反应前F管及内盛物的总质量d⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的不含“c”字母的一个计算式(可以不写单位。除W外,其他涉及的元素的相对原子质量均为已知):
计算式:Ar(W)=____________;
(5)此实验除了要对G口余气作处理外,似还有待改正之处,否则会引起较大的误差,你认为应该作何改正?________________________。
、钡盐生产中会排出大量的钡泥[主要含有 、
、 、
、 、
、 等]。某化工厂主要生产
等]。某化工厂主要生产 、
、 、
、 ,现利用钡泥制取
,现利用钡泥制取 ,其部分工艺流程如下:(已知:(1)FeO2-极易水解而生成Fe(OH)3(2)Fe3+在pH=3.7时即可水解即沉淀完全)
,其部分工艺流程如下:(已知:(1)FeO2-极易水解而生成Fe(OH)3(2)Fe3+在pH=3.7时即可水解即沉淀完全)
(1)酸溶后溶液中 ,
, 与
与 的反应化学方程式为:
的反应化学方程式为:
。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,其原因是防止反应速率过快、浓硝酸挥发且易。
(3)该厂结合本厂生产实际选用的X为(填化学式);“中和Ⅰ”会使溶液中(填离子符号)的浓度减少。
(4)从 溶液中得到其晶体的分离方法叫。
溶液中得到其晶体的分离方法叫。
(5)废渣可直接排放。上述流程中洗涤的目的是。
(15分)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。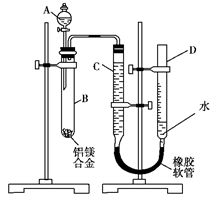
(1)A中试剂为。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是______________
___________________________________________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应__________________。
(4)B中发生反应的化学方程式为__________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 。(填“偏大”、“偏小”、“不受影响”)
立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径。
(1)实验1:取一块金属钠,在玻璃片上用滤纸吸干表面的煤油后,用小刀切去一端的外皮。观察钠的颜色。这个实验中还需用到的一种仪器是;
(2)实验2:向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯。把反应的现象和相应结论填入空格。“浮”---钠的密度比水小;“熔”--- ;“红”---反应生成了氢氧化钠;
(3)实验3:在两支试管里分别加入5mL 盐酸和5mL NaOH溶液,在各放入一小段铝片,观察实验现象。试写出铝和NaOH溶液反应的离子方程式:;
(4)实验4:把水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验生成的气体。向反应后的溶液中加入酚酞试液,可以看到;
(5)实验5:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气。该氧化还原反应的氧化剂是;
(6)实验6:在试管里注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色。发生这种颜色变化的原因是(用化学方程式表示):。
(7分)某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。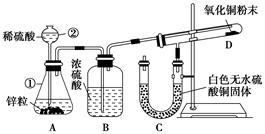
(1)写出编号仪器的名称:
①________,②________。
(2)浓硫酸的作用是_________________________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1个水分子,转移的电子数为________。