使一定质量的Zn与100mL18.5mol/L的浓硫酸充分反应,Zn完全溶解,同时生成标准状况下的气体A为33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L。求气体A中各组分的体积比
是食品工业中常用的漂白剂、抗氧化剂和防腐剂。
在30
时的溶解度为35.5
/100
。
1)计算30
时
饱和溶液中
的质量分数
。(保留2位小数)
2)计算30
时271
饱和溶液中水的质量。
3)将30 的 饱和溶液271 冷却到10 ,析出 晶体79.5 。计算10 时 在水中的溶解度。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:。
⑵ 煤的气化过程中产生的有害气体
用
溶液吸收,生成两种酸式盐,该反应的化 学方程式为:。
学方程式为:。
⑶ 利用水煤气合成二甲醚的三步反应如下:
①

②

③

总反应:
 =;
=;
一定条件下的密闭容器中,该总反应达到平衡,要提高
的转化率,可以采取的措施是(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加
的浓度 e.分离出二甲醚
⑷ 已知反应②
 某温度下的平衡常数为400 。此温度下,在密闭容器中加入
,反应到某时刻测得各组分的浓度如
某温度下的平衡常数为400 。此温度下,在密闭容器中加入
,反应到某时刻测得各组分的浓度如 下:
下:
| 物质 |
|
||
| 浓度/(
) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:
(填">"、"<"或"=")。
② 若加入
后,经10
反应达到平衡,此时
(
) =;该时间内反应速率
(
) =。
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:SO2+2Fe3++2H2O═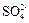 +2Fe2++4H+
+2Fe2++4H+
Cr2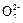 +6Fe2++14H+═2Cr3++6Fe3++7H2O
+6Fe2++14H+═2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)。
(2)若灼烧6gFeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式。
(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为L,制得98%在硫酸质量为t,SO2全部转化为H2SO4时放出的热量是kJ。
实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平)KClO3+HCl——HCl+Cl2↑+H2O
(1)配平上述反应化学方程式:
KClO3+ HCl——KCl+ Cl2↑+ H2O
(2)若产生0.1mol Cl2,则转移电子的物质的量为mol。
(3)若反应中HCl的的利用率只有50%,当氧化产物比还原子能产物多7.1g时,求浓盐
酸的物质的量浓度。
过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化钙样品的组成,进行了如下实验。
① 称取0.270 g样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下体积为33.6 mL。
② 另取0.120 g样品,溶于稀盐酸,加热煮沸,使生成的H2O2完全分解。然后将溶液中的Ca2+ 完全转化为CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200 mol·L-1 KMnO4溶液滴定,共用去31.0 mL KMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4= K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O
(1) 写出CaO2受热分解的化学方程式。
(2) 计算样品中CaO2的质量分数。
(3) 计算样品中CaO2·x H2O的x值。