G是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是 。
(2)B→C的反应类型是 。
(3)E的结构简式是 。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
。
(5)下列关于G的说法正确的是 。
a.能与溴单质反应 b.能与金属钠反应
c.1molG最多能和3mol氢气反应 d.分子式是C9H6O3
(6)与D互为同分异构体且含有酚羟基、酯基的有 种
(4-5必做)根据已学知识,请你回答下列问题:
(1)最外层电子排布为4s24p1的原子的核电荷数为__________。某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(2)根据VSEPR模型,PO43-的分子立体结构为:;乙醇易溶于水的原因是;HClO4的酸性强于HClO的原因是;
(3)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素原子的电子排布式是_____。写出铬元素在周期表中的位置________,它位于______区。
(5)如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a pm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为 g/cm3。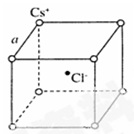
(1、2、3班必做)根据题意回答下列问题
(1)写出基态Fe2+离子核外电子排布式;基态氟原子价电子排布图。
(2)电负性:S O(填写“<”或“>”,下同));第一电离能:N F。H3O+空间构型是,SO32-离子中S杂化类型是。
(3)HCN分子中σ键与π键数目之比为___________。
(4)与CN‑互为等电子体的分子是(写分子式)。
某短周期非金属元素固体单质A,呈淡黄色。它与另一常见的短周期金属单质B在加热条件下反应生成化合物 C,C 与水反应生成白色沉淀 D 和一种臭鸡蛋味的气态氢化物 E,D 是某元素的最高价氧化物的水化物,既能溶于强酸,又能溶于强碱。E 在足量空气中燃烧时,有刺激性气味的气体 G生成,G 在大气中能导致酸雨的形成。E 被足量氢氧化钠溶液吸收得到无色溶液 F。溶液 F 在空气中长期放置发生反应,生成物之一为 H。H 与过氧化钠的结构和化学性质相似。请回答下列问题:
(1)组成单质 A的元素在周期表中的位置。
(2)写出化学式:沉淀D,臭鸡蛋味气体 E。
(3)G 与氯水反应的氧化产物为__________。(填化学式)
(4)溶液 F 在空气中长期放置生成 H 的化学方程式为:_____________。
(5)H 的溶液与稀硫酸反应产生的现象为________________。
有电化学装置如图连接,请回答下列问题:
(1)图中甲、乙两池的名称:甲池是装置;乙池是装置。
(2)请回答下列电极的名称:通入H2的电极名称是,C(石墨)电极的名称是。
(3)写出电极反应式:通入O2的电极的电极反应式是。
(4)乙池中反应的化学方程式为。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗H2mL(标准状况下)。
Ⅰ)如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回答:
(1)实验中能观察到的现象是____________________。(选填代号)
| A.试管中镁片逐渐溶解 | B.试管中产生无色气泡 |
| C.烧杯外壁变冷 | D.烧杯底部析出少量白色固体 |
(2)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。
Ⅱ)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是,除此之外还有一处错误的是。
(2)大烧杯上如不盖硬纸板,求得的中和热数值(绝对值)(填“偏大、偏小、无影响”)。
Ⅲ)(1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)===CO2(g) ΔH=E1①
b.C(s)+H2O(g)===CO(g)+H2(g)ΔH=E2②
H2(g)+ O2(g)===H2O(g)ΔH=E3③
O2(g)===H2O(g)ΔH=E3③
CO(g)+ O2(g)===CO2(g)ΔH=E4④
O2(g)===CO2(g)ΔH=E4④
请表达E1、E2、E3、E4之间的关系为E2=_________________。
(2)如图所示是1摩尔NO2 和1摩尔CO完全反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:。
(3)化学反应的焓变与反应物和生成物的键能有关。已知某些化学键的键能如下表所示:
| 共价键 |
H—H |
Cl—Cl |
H—Cl |
| 键能/(kJ·mol-1) |
436 |
247 |
434 |
则反应:H2(g)+Cl2(g)=2HCl(g)的焓变ΔH =。