铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。有关含铬化合物的相互转化关系如下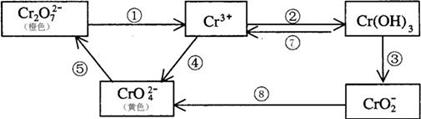
回答下列问题:
(1)上述反应中需用氧化剂的是 (填编号)。
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应和溶液中进行的反应的离子方程式:
阳极 阴极
溶液中
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式 。
(每空2分,共14分)已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45%~50%),另一个产物A也呈酸性,反应方程式如下: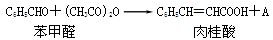
(1)Perkin反应合成肉桂酸的反应式中,反应物的物质的量之比为1:1,产物A的名称是。
(2)一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其反应方程式为。
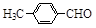
(3)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:
| 取代苯甲醛 |
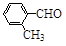 |
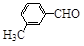 |
 |
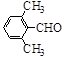 |
| 产率(%) |
15 |
23 |
33 |
0 |
| 取代苯甲醛 |
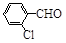 |
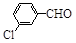 |
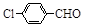 |
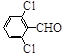 |
| 产率(%) |
71 |
63 |
52 |
82 |
可见,取代基对Perkin反应的影响有(写出3条即可):
①________________________________
②____________________
③________________________________
(4)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯(PbCl2)催化下可直接合成肉桂酸乙酯,该反应属于Beck反应,是芳香环上的一种取代反应,其反应方程式为____。
(5)Beck反应中的有机产物不能发生的反应是__________(填字母)。
(A)加成反应(B)取代反应(C)氧化反应(D)消去反应
(14分,每空2分)下图表示的反应关系中,部分产物被略去。已知2 mol白色固体粉末X受热分解,恢复到室温生成白色固体A、无色液体B、无色气体C各1 mol。X、E、G的焰色反应均为黄色。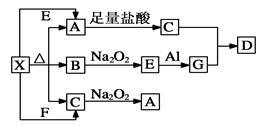
回答下列问题:
(1)写出下列物质的化学式:G______,D______。
(2)写出G与C反应生成D的化学反应方程式:____________________________。
(3)写出X+E→A的离子方程式:______________________________________。
(4)写出C与Na2O2参加反应的化学方程式:_____________________________。
0.2 mol Na2O2转移的电子数为________个。
(5)写出物质X的用途(至少写出一种)________。
(15分,每小题3分)某厂的酸性工业废水中含有一定量的Na+、Al3+、Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。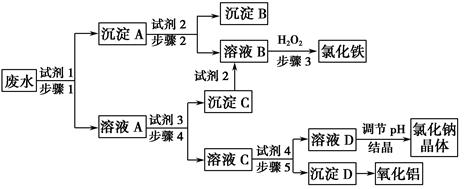
请填写下列空白:
(1)图中试剂1是____,试剂2是_____。
(2)步骤1和步骤2所用到的玻璃仪器是________。
(3)步骤1反应的离子方程式为____________________。
(4)步骤3反应的离子方程式为____________________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为____。
除去下列物质中所含有的杂质(括号内为杂质),将选用的试剂及分离方法填在题后的横线上,涉及化学反应的并写出有关反应的化学方程式(是离子反应的,写出其离子方程式)。
(1)Fe2O3[Fe(OH)3]________,__________________;
(2)FeCl3溶液(FeCl2)________,______________________;
(3)Fe(Al)___,_______________________。
(4)CO2(SO2),。
(5)SiO2(Al2O3),。
(6)淀粉溶液(氯化钠)。
(7)KNO3(NaCl)。
(8)Br2(H2O)。
(12分)含有下列离子的五种溶液①Ag+②Mg2+③Fe2+④Al3+⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是________(填离子符号,下同)。
(2)向③中加入NaOH溶液,现象是______________________________,
有关方程式(是离子反应的写离子方程式)为__________________。
(3)加入过量NaOH溶液无沉淀的是_____________。
(4)加入铁粉若溶液质量增重的是_______,若溶液质量减轻的是_______________。
(5)遇KSCN溶液呈红色的是______________。
(6)能用来鉴别Cl-存在的离子是_______________。