能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;该反应属于 (填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是
| A.起始充入的CO为1mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大 |
(3)从反应开始到建立平衡, v(H2)= ;该温度下CO(g)+2H2(g) 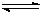 CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2)。
(5)科学家常用 (填仪器名称)来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol,又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
将下列物质进行分类:
①11H与13H;②O2与O3;③乙醇与甲醚(CH3-O-CH3);④H2O与D2O;⑤CH3CH2CH2CH3与CH3-CH(CH3)-CH3;⑥C60与C70;⑦CH4与C4H10
(1)互为同位素的是 (填编号,下同);互为同素异形体的是
互为同分异构体的是互为同系物的是
(2)有下列反应:①由乙烯制乙醇;②甲烷在空气中燃烧;③由乙烯制氯乙烷;④丙烯使溴水褪色;⑤苯与浓硝酸、浓硫酸的混合酸反应;⑥用丙烯制聚丙烯;其中属于取代反应的是(填序号,下同),属于氧化反应的是,属于加成反应的是,属于加聚反应的是。
(3)①正丁烷;②异丁烷;③正戊烷;④异戊烷;⑤新戊烷;⑥丙烷,物质的沸点由高到低的排列顺序是:
(4)某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 cm 处; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)__________________________________。
按要求完成下列填空:
(1)乙烯发生聚合反应的方程式为:
(2)苯的硝化反应的化学方程式为:
(3)乙醇在铜存在条件下催化氧化的方程式为:
(4)写出CH3C18O16OH与C2H518OH发生酯化反应的方程式::
(5)写出磁性氧化铁与铝粉发生反应的化学方程式:
为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:
0.10mol/L醋酸溶液、pH=3的盐酸、pH=3的醋酸、NaAC晶体、NaCL晶体、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)
(2)乙取出10ml0.10mol/L的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏稀释到1000mL,在用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是(用“等式”或“不等式”表示)
(3)丙将pH=3醋酸和盐酸,各取10ml,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小,则认定醋酸是弱电解质,你认为这一方法正确吗?
(填“正确”或“不正确”)
(4)丁将pH=3醋酸和盐酸,分别加入相应的钠盐固体,醋酸的PH变化大,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)。
(5)戊取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)。
研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g)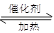 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
| 反应时间/min |
n(NO2)/mol |
n(NH3)/ mol |
| 0 |
1.20 |
1.60 |
| 2 |
0.90 |
|
| 4 |
0.40 |
(1)反应在2min内的平均速率为v(NH3)=,4min该反应达到平衡状态,则该反应的平衡常数K的表达式为,NO2的转化率为
(2)700℃ ,将NO2与NH3以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.体系密度保持不变
d.每消耗1 mol NO2的同时生成2 mol H2O
(14分)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。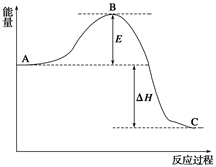
请回答下列问题:
(1)图中A、C分别表示__________、______________,E的大小对该反应的反应热有无影响?______________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________;
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=________mol/(L·min)
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=_ _。