研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g)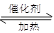 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
| 反应时间/min |
n(NO2)/mol |
n(NH3)/ mol |
| 0 |
1.20 |
1.60 |
| 2 |
0.90 |
|
| 4 |
|
0.40 |
(1)反应在2min内的平均速率为v(NH3)= ,4min该反应达到平衡状态,则该反应的平衡常数K的表达式为 ,NO2的转化率为
(2)700℃ ,将NO2与NH3以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.体系密度保持不变
d.每消耗1 mol NO2的同时生成2 mol H2O
有一种蓝色晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,而CN-离子位于立方体的棱上。
(1)根据晶体结构特点,推出其化学式(用最简单整数示)________ __________________。
(2)此化学式带何种电荷?用什么样的离子(用Mn+表示)与其结合成中性的化学式?写出此电中性的化学式。
(3)指出(2)中添加离子在晶体结构中的什么位置。
某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着__________个X,每个x同时吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。
晶态氯化钠是 晶体,晶体中,每个钠离子周围有 个氯离子,每个氯离子周围有 个钠离子,钠离子半径比氯离子半径 。在氯化物MCl中,M在第六周期,是钠的同族元素,该晶体中,每个阳离子周期有 氯离子。钠的金属性比M 。氯化钠的电子式是 ,熔融后 导电(填“能”或“不能”)。Na+(或Cl-)周围的6个Cl- (或Na+)相邻的连线构成的面是多面体;每个Na+(或Cl-)周围与之距离最近且距离相等的Na+(或Cl-)有 个?
请表示出下列方程式中电子转移的方向和数目,并回答下列问题
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O
(1)此反应中,氧化剂是,还原剂与氧化剂的物质的量之比是
(2)当生成1.5mol I2时转移的电子数是
海带中含有碘元素,碘缺乏者宜多食海带,为检测海带中是否含有碘元素,实验人员将海带在坩埚中烧成灰渣后加水搅拌,使海带中的碘离子溶于水,然后在所得澄清溶液中通入适量氯气,将碘离子转变成单质碘,为进一步检验溶液中单质碘的存在,人们利用碘易溶于四氯化碳溶剂且呈紫红色的特殊性进行确认,最终发现海带中含碘。在上述实验中未提到的两步常见分离操作的名称是:、。