(1)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得如下数据:
| 序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
12 |
| ② |
22.00 |
18.00 |
11 |
| ③ |
22.00 |
22.00 |
7 |
x= ____________ ;Ba(OH)2溶液的物质的量浓度为____
(2)常温下,向100mL pH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH ______7(填“>”“<” 或“=”);原混合溶液中硫酸钠的物质的量浓度为
某烃A的相对分子质量是156,在CCl4溶液中跟Br2不起反应,但在光照下,Br2可以跟A起取代反应,取代产物的相对分子质量是235的有两种:产量较多的一种是B,产量较少的一种是C。另外,还可得到相对分子质量为314的产物多种。
(1)请写出A、B、C的结构简式:
ABC
(2)相 对分子质量为314的产物有种。
对分子质量为314的产物有种。
A、B、C、D是四种气态烃,其中A、B 、C能使溴水褪色。1摩尔C与2摩尔氯气完全加成,生成物分子中每个碳原子上都连有氢原子和氯原子。A与C、B与D分别具有相同的通式,A在催化剂存在下与氢气反应可得到B,在同温同压下B与氮气的密度相同,D没有同类的异构体,则四种气态烃的名称分别是:
、C能使溴水褪色。1摩尔C与2摩尔氯气完全加成,生成物分子中每个碳原子上都连有氢原子和氯原子。A与C、B与D分别具有相同的通式,A在催化剂存在下与氢气反应可得到B,在同温同压下B与氮气的密度相同,D没有同类的异构体,则四种气态烃的名称分别是:
A、B、C、D。
(1)按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类:
①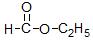 _________;②
_________;②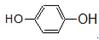 ________。
________。
(2)用系统命名法给下列有机物命名:
①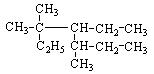 ;②
;②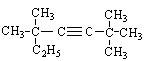 。
。
(3)写出由电石制聚氯乙烯的化学方程式:。
某实验小组利用饱和食盐水、导线、直流电源(用“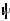 ” 或“
” 或“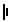 ”表示)、烧杯、灵
”表示)、烧杯、灵
敏电流计(用“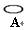 ”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
甲同学安装好仪器,接好直流电源通电几分钟,发现M处溶液逐渐变浅绿色,过一段时间,溶液变得浑浊且逐渐出现红棕色。
乙同学所用的仪器和甲同学的看上去相同,但接好直流电源通电几秒钟,却闻到一股刺鼻的气味,马上停止通电。
丙同学安装好仪器,线路闭合几秒钟后,却没有发现明显现象产生,他又很快接入灵敏电流计,发现电流计的指针发生了偏转。
请根据上述同学的实验现 象回答以下问题:
象回答以下问题:
(1)M电极棒材料是(写化学式),N电极棒材料是(写化学式)。
(2)在下列虚框内完成对应三个同学的装置图: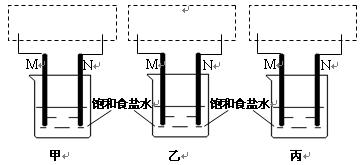
(3)按要求写出三个同学实验过程中涉及的反应方程式:
甲同学N电极方程式
乙同学总反应的离子方程式
丙同学N电极方程式
(4)用化学方程式解释甲同学实验时观察到M处溶液出现浑浊后转为红棕色现象的原因: 。
。
(5)丙同学为了保护M电极不被腐蚀,他可以将N电极棒更换为(写化学式)。为验证该防护方法有效,他又做下列对比实验:接通电路2分钟后,分别在M电极区滴入2滴黄色K3[Fe(CN)6]溶液,发现没有更换N电极棒的烧杯中的现象是。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题: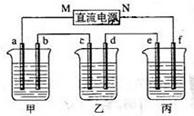
(1)电源的N端为极;
(2)写出电解前后各溶液的pH变化情况(增大、减小或不变 ):
):
甲溶液;乙溶液;丙溶液;
(3)电极b上生成的气体在标准状态下的体积是;
电极c的质量变化是g。