随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)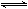 N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H 0(填“>”、“ =”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式 。
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为 。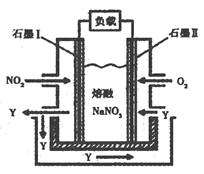
A~T十多种物质存在下图所示关系(其中有 机反应的部分产物已省略)。已知A为过渡元素,B在常温下为液体,E、G为可燃性气体,R为黄绿色
机反应的部分产物已省略)。已知A为过渡元素,B在常温下为液体,E、G为可燃性气体,R为黄绿色 气体,K遇单质碘变蓝色,L、P能与银氨溶液发生银镜反应。其中S的分子式为C4H4O4,其分子中有一个六元环,T为高分子化合物。
气体,K遇单质碘变蓝色,L、P能与银氨溶液发生银镜反应。其中S的分子式为C4H4O4,其分子中有一个六元环,T为高分子化合物。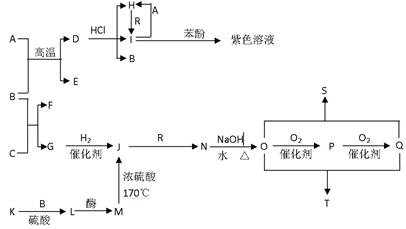
试回答下列问题:
(1)下列有关K的说法正确的是。
A.K与纤维素是同分异构体
B.K与L是同系物
C.K是一种无臭、有甜味的粉末状物质
D.K是重要的食品工业原料,用于制备葡萄糖、酿制食醋、酿酒,也是药片中的黏合剂
(2)R与B溶液反应后的溶液具有。
A .漂白性B.氧化性C.还原性D.酸性
.漂白性B.氧化性C.还原性D.酸性
(3)M与Q完全反应生成的有机产品是(填名称)
(4)写出下列反应的离子方程式:
① D+HCl→H+I+B。
② P与银氨溶液反应。
(5)写出下列反应的化学方程式:
① B+C→F+G。
② O+Q→S。
按要求完成下列填空:
(1)下列有机物中有结构简式却没有名称的请用系统法命名:
①甲烷②CH3-C(CH3)=CH-CH=CH2名称: ③乙炔④甲苯⑤CH2(OH)-CH-CH2-CH3
③乙炔④甲苯⑤CH2(OH)-CH-CH2-CH3
CH2OH名称:
(2)第(1)小题所列物质中:(以下各小题填序号回答)
Ⅰ.分子中中心原子采取sp杂化的是;
Ⅱ.核磁共振氢谱只有一个吸收峰的是;
Ⅲ.分子与分子之间存在氢键的是;
Ⅳ.能与溴水反应并使其褪色的是;
(每空2分)反应A()+B()  C() +D()过程中的能量变化如图所示,回答下列问题。
C() +D()过程中的能量变化如图所示,回答下列问题。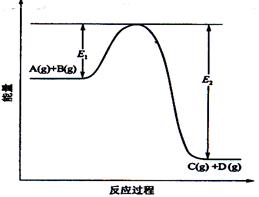
(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),
原因是____________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________:
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
废旧印刷电路板的回收利用可实现资再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是(填字母)。
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用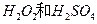 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: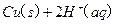 ====
====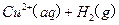
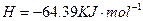
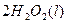 ====
====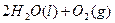
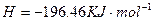
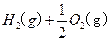 ="==="
="===" 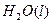
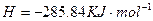
在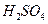 溶液中
溶液中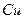 与
与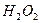 反应生成
反应生成 和
和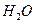 的热化方程式为。
的热化方程式为。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅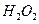 和3.0
和3.0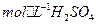 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜平均溶解速率 ( 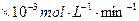 )[:.....] )[:.....] |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是。
(4)在提纯后的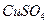 溶液中加入一定量的
溶液中加入一定量的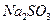 和
和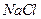 溶液,加热,生成
溶液,加热,生成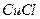 沉淀。制备
沉淀。制备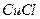 的离子方程式是。
的离子方程式是。
(每小题3分,共9分)恒温恒压下,在一个容积可变的密闭容器中发生如下反应:
(1)若开始时通入 ,达平衡时生成
,达平衡时生成 的转化率为。
的转化率为。
(2)若开始时通入 ,达平衡时SO2的物质的量为mol。
,达平衡时SO2的物质的量为mol。
(3)若在(2)的平衡混合物中再通入bmol SO3,则达到平衡时SO3的体积分数是。