某研究性学习小组拟用硝酸钠和氯化钾混合物,来制取较纯净的硝酸钾晶体,他们设计了如下流程:
请根据以上流程,回答相关问题:
(1) 操作①的名称是 。
(2)参照如下左图溶解度曲线,写出固体A、B的化学式:
A , B 。欲得到较纯的硝酸钾晶体需用少量的 (填“热水”,“冷水”)洗涤固体
(3)在操作②的过程中要用到减压的方法进行过滤,叫减压过滤,俗称抽滤。下图为减压过滤装置,回答有关问题。
①写出图中A、B、C三种仪器的名称:
A ;B ;C 。
②采用减压过滤的目的是 。
③请指出图中的两处错误 ;
④吸滤完毕时,应先拆下B与C或C和抽气泵间的橡皮管,然后关闭水龙头,其原因是 。
(4)固体B中杂质的检验方法 。
PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
| 熔点/℃ |
沸点/℃ |
密度/g·mL-1 |
其他 |
|
| 黄磷 |
44.1 |
280.5 |
1.82 |
2P(过量)+3Cl2 2PCl3;2P+5Cl2 2PCl3;2P+5Cl2 2PCl5 2PCl5 |
| PCl3 |
—112 |
75.5 |
1.574 |
遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 |
2 |
105.3 |
1.675 |
遇水生成H3PO4和HCl,能溶于PCl3 |
(一)制备:RU 图是实验室制备PCl3的装置(部分仪器已省略)
(1)仪器乙的名称____________。
(2)实验室用漂白粉加浓盐酸制备Cl2的化学方程式:_______________________ 。
(3)碱石灰的作用是____________________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一 段时间的CO2,其目的是____________________。
(二)提纯:
(5)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过_________________(填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取4.200 g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的0.1000 mol/L 20.00 mL 碘溶液,充分反应后再用0.1000 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗10.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为____________________ 。若滴定终点时俯视读数,则PCl3的质量分数_______(偏大、偏小、或无影响)
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验,请回答下列问题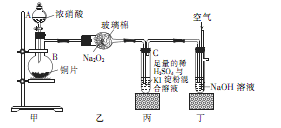
(1)装置甲中盛放浓硝酸的仪器A的名称是,仪器B中发生反应的化学方程式为
(2)完成下面表格中的空白
(3)取下装置丙中的试管C,向其中滴加足量的Na2SO3溶液,溶液颜色褪去,该过程中发生反应的离子方程式为。反应后的溶液中主要含有SO32—、SO42—、I—等阴离子,请填写鉴定SO32—、SO42—和I—的实验报告。
限选试剂:2mol·L—1HCl、1mol·L—1H2SO4、1mol·L—1BaCl2、1mol·L—1Ba(NO3)2、CCl4、新制饱和溴水、新制饱和氯水。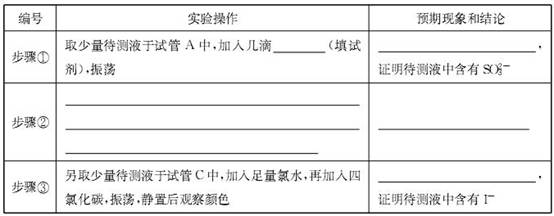
氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,图1是模拟制取装置:
(1)装置B的作用是;装置D的作用是;
(2)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,(请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间②收集气体并检验其纯度
③关闭分液漏斗活塞④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是:。
(4)甲同学设计一个实验,测定上述实验中得到的氢化钙的纯度(杂质中不含钙元素。请完善下列实验步骤:
①样品称量;②加入________溶液(填化学式),搅拌、过滤;③________(填操作名称);④_______(填操作名称); ⑤称量碳酸钙。
(5)乙同学利用注射器测量氢化钙和水反应氢气体积的方法,测定上述实验中得到的氢化钙的纯度。他称取46 mg 所制得的氢化钙样品,记录开始时注射器活栓停留在10.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定)。试通过计算求样品中氢化钙的纯度:。
(6)请你再设计一种氢化钙纯度的测定方法:。
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
(1)若某种固体物质受热发生了分解,下列说法正确的是()
A.充分加热后一定有固体残留 B.加热前后固体颜色一定无变化
C.加热前后固体质量一定有变化 D.一定生成了新的物质
E.充分加热后得到的残留固体一定为混合物
(2)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体,则Na2SO3固体加热到600℃以上分解的化学方程式。如果加热温度低于600℃,向所得固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3—的物质的量浓度变化趋势为;
(3)如果加热温度高于600℃一段时间后,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为;此时在B、C两装置中可能观察到得现象为。
(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,以下是检验阴离子(X)的两种实验方案,你认为合理的方案是(填“甲”或“乙”),请说明另一方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
查找资料发现,N2制取有下列不同方案:
a方案:加热条件下NH3还原CuO制得纯净的N2和活性铜粉
b方案:加热NaNO2和NH4Cl的浓溶液制得
c方案:将空气缓慢地通过灼热的铜粉制得较纯的N2
现在实验室有供选择的如下几种仪器来制取N2
(1)若按 方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。
方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。
(2)写出b方案中反应的化学方程式_________________________
(3)若按 方案制取N2,则氮气中一定混有何种杂质气体 ______________________
方案制取N2,则氮气中一定混有何种杂质气体 ______________________
(4)上述制N2的三个方案中, 方案结合使用越来越受到人们的关注,这种方法与
方案结合使用越来越受到人们的关注,这种方法与 方案相比,其优越性在于____________。
方案相比,其优越性在于____________。