已知Cl2和碱溶液在不同条件下,得到的产物不同。某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。(3Cl2+6KOH KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )
图中:A为氯气发生装置;B的试管里盛有15 mL 30% KOH溶液,并置于水浴中;C的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液。请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过 (填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式为 。需要向烧瓶中加碎瓷片吗? (选填:“需要”、“不需要”)。
(2)反应结束后,烧瓶里的溶液 。
A一定显酸性;B可能显酸性,也可能为中性;C只有氧化性;D只有还原性;E既有氧化性又有还原性
(3)反应完毕,B试管中有少量晶体析出,经冷却后,有大量晶体析出。图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体必须用到的玻璃仪器有 。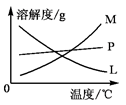
(4)该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有HCl气体。对此问题可以通过改进实验装置的方法进行避免。方法是 。
(5)实验中可观察到D的试管里溶液的颜色由紫色先变为_________色,最终变为________色。
(6)C装置中反应完毕的现象是______________________________________________。
(7)请在装置图方框中画出缺少的实验装置,并注明试剂。
某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
Ⅰ、用下列实验装置制取纯净干燥的氯气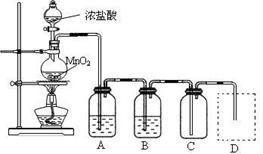
写出A、B中所盛放最佳化学试剂的名称、,画出虚线框内所需装置图并标明所需试剂的名称。
Ⅱ、某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:;假设③:。
(2)设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
| 实验方法 |
实验现象 |
结论 |
| 在溶液中加 KSCN溶液 |
固体物质中有FeCl3 |
|
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液紫色 不褪色 |
固体物质中不含______ |
由此得出结论:假设成立(填序号①②③)。
Ⅲ、为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是_____________(填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Ksp[Fe(OH)3]< Ksp[Mg(OH)2]
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
IV、a溶液常作印刷电路铜板的腐蚀剂,写出发生反应的离子方程式。活动小组的同学们又设计了两种从上述废液中回收Cu的方案:
方案1:设计流程图如下: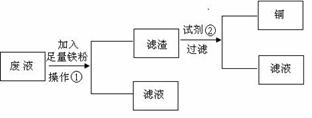
请分别写出操作①和试剂②的名称_________,_______。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,铜作________极。当观察到阴极有少量气泡产生时,停止电解,这时要回收的Cu已全部析出。
评价:方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:。
某活动小组设计了以下实验,其实验目的是观察两份完全相同的铁粉与铝粉的混合物分别与足量盐酸和NaOH溶液反应的删程;测定部分数据对混合物的成分进行定量分析。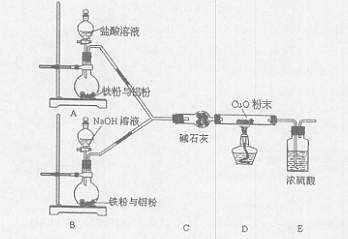
请回答:
(1)碱石灰的作用是。
(2)下列操作进行的顺序由先到后的是(填序号)。
①同时打开A、B中分液漏斗的活塞,分别加人足量试剂
②检查装置的气密性③点燃酒精灯
④装入药品⑤熄灭酒精灯
⑥同时关闭A、B中分液漏斗的活塞
(3)写出B装置中发生反应的离子方程式:。
(4)写出装置A、B中实验现象的不同点。
(5)该装置不够完善,还需增加的装置为。
(6)已知反应前金属混合物的质量,发生反应后测定混合物成分的最简单方法是。
(7)若混合金属中铁与铝的质量比为28:27,则充分反应后,A和B两烧瓶中转移电子总数之比为。
已知非金 属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: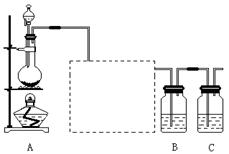
(1)装置A的分液漏斗中盛装的试剂是,烧瓶中加入的试剂是。
(2)虚线框内的实验装置图,所加试剂为,说明装置的作用。
(3 )装置B中盛放的试剂是(选填下列所给试剂的代码),实验现象为,
)装置B中盛放的试剂是(选填下列所给试剂的代码),实验现象为,
化学反应方程式是,
该反应属于四种基本反应类型中的反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)从原子结构的角 度简要分析氯元素的非金属性比硫元素的非金属性强的原因。
度简要分析氯元素的非金属性比硫元素的非金属性强的原因。
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由。
。
(12分)下图是一个制取氯气并以氯气为原料进行某些反应的装置。(夹持和加热装置省略)。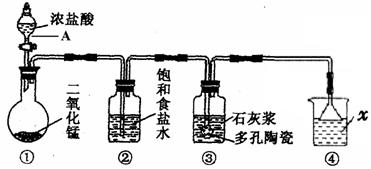
(1)写出图中仪器A的名称:。
(2)装置中x试剂为;装置中饱和食盐水的作用是。
(3)装置③中发生反应的化学方程式为。
(4)若将生成的C12通入淀粉碘化钾无色溶液中,可观察到溶液变成色,反应的离子方程式为。
某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 |
铁的质量/g |
铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol·L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
| 1 |
0.10 |
片状 |
50 |
0.8 |
20 |
200 |
| 2 |
0.10 |
粉状 |
50 |
0.8 |
20 |
25 |
| 3 |
0.10 |
片状 |
50 |
1.0 |
20 |
125 |
| 4 |
0.10 |
片状 |
50 |
1.0 |
35 |
50 |
请分析上表信息,回答下列问题。
(1)实验1、2 表明 对反应速率有影响,其规律是 。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是。
(忽略温度对反应速率的影响)