下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
(1)元素⑥名称为 在周期表中位于第 周期,第 族,元素⑧的原子结构示意图是 。
(2)⑥、⑦氢化物的稳定性 > (填化学式)。
(3)①、②、③三种元素按原子半径由小到大的顺序依次为 (填元素符号)。
(4)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的是_____________,该化合物属于 (填 “共价”或“离子”)化合物。
(5)④元素与⑦元素形成的化合物的电子式是 ,高温下灼烧该化合物时,火焰呈 色。
(6)元素⑤的单质与稀硫酸的反应是 (填“放热”或“吸热”)反应。
(1)向盛有硫酸铜水溶液的试管里逐渐滴加氨水至过量,观察到的实验现象是:其反应的离子方程式为:.
(2)利用VSEPR理论推测下列分子或离子的空间构型:CO32-和SO32-的空间构型分别为和。其中心原子的杂化方式分别是和
用符号“>”“<”或“=”连接下列各项关系。
(1)第一电离能NO;(2)电负性:NC;
(3)键的极性:H-CH-Si ;(4)键角:H2SNH3
(5)晶格能:MgO______KI(6)分子中π键数目:C2H4C2H2
(4分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体细粒干燥后,准确称取m gNaCl固体细粒并转移到定容仪器A中
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用(填序号)
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
(2)步骤②中是否用酸式滴定管还是用碱式滴定管,理由是
(3)能否用水代替苯,理由是。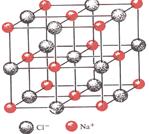
NaCl晶体结构图
(4)已知NaCl晶体中,靠得最近的Na+、Cl—间的距离为a cm(如上图),则用上述方法测得的阿佛加德常数NA的表达式为。
元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
| A |
|||||||||||||||||
| D |
E |
||||||||||||||||
| G |
Q |
M |
R |
||||||||||||||
| T |
|||||||||||||||||
(1)某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为。 (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)。
(3)M、D两种元素形成的化合物含有的化学键类型是,其分子是(填“极性”或“非极性”)分子;
A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式)。
A与D形成分子的空间结构可能是(填序号)。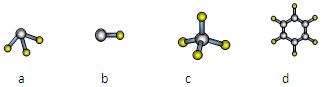
有A、B、C、D、E、F六种元素,已知:
①.它们位于三个不同短周期,核电荷数依次增大.
②.E元素的电离能数据见下表(kJ·mol-1):
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4562 |
6912 |
9540 |
… |
③.B与F分别同主族.
④.A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物.
⑤.B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.
⑴写出A、B、C、D、E、F元素符号分别为___________________________________,
只含有A、B、D、E四种元素的两种无水盐的化学式 _____ ._____________.
(2)B2A2分子结构式______________中存在____个σ键,_____个兀键.
(3)下列四种物质形成的晶体,熔点由高到低的顺序(用a、b、c 、d表示):.
a.F与B形成的化合物 b.B与D形成的稳定化合物
c.F的单质 d. E与D形成的化合物