某气体通入品红溶液中,溶液褪色,加热后又恢复为原来颜色。该气体是
| A.O2 | B.SO2 | C.CO2 | D.H2 |
有机物C4H8O3在浓硫酸存在下具有下列性质:①能分别与乙醇或乙酸反应;②能脱水生成一种只存在一种结构形式,且能使溴水褪色的物质;③还能生成一种分子式为C4H6O2的五元环状化合物。根据上述性质,确定C4H8O3的结构简式为
| A.HOCH2COOCH2CH3 | B.CH3CH(OH)CH2COOH |
| C.CH3CH2CH(OH)COOH | D.HOCH2CH2CH2COOH[ |
有机反应的类型有:①取代,②加成,③消去,④氧化,⑤还原,⑥酯化,⑦水解等,上述反应类型中,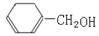 可能发生的有
可能发生的有
| A.4种 | B.5种 | C.6种 | D.7种 |
下列实验操作中,正确的是
19.
| A.在CuSO4溶液中滴入少量NaOH溶液,来配制新制Cu(OH)2悬浊液 |
| B.在稀氨水中逐渐加入稀的硝酸银溶液来配制银氨溶液 |
| C.除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 |
| D.溴乙烷在氢氧化钠存在下进行水解后,加入硝酸银溶液,可检验溴元素的存在 |
乙酸乙酯在含18O的酸性水溶液中水解,所得产物含有18O的是
| A.乙酸和乙酸乙酯 | B.乙醇 | C.乙酸乙酯和乙醇 | D.乙酸 |
A、B、C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶ 6∶ 2,则A、B、C三种醇分子里羟基数之比是
A. 3∶2∶1 B. 2∶6∶3 C. 3∶1∶2 D. 2∶1∶3