(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 ;
若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极。
(2)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:
2PbSO4 + 2H2O Pb + PbO2 + 2H2SO4
Pb + PbO2 + 2H2SO4
铅蓄电池放电时, (填物质名称)在负极发生反应。放电过程中硫酸浓度由5mol/L下降到 4mol/L,电解液体积为2000mL(反应过程溶液体积变化忽略不计);求放电过程中外电路中转移电子的物质的量为 mol。
(3)有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:
正极:
ⅤA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为(用元素符号表示)。
(2)As原子核外M层电子的排布式为。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N互为等电子体的分子的化学式(任写一种即可)。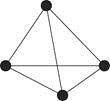
图1
(4)白磷(P4)的结构如图1所示,P原子的轨道杂化方式是。
(5)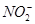 可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
①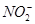 的立体构型是。
的立体构型是。
②在K3[Co(NO2)6]中,中心离子的配位数为。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体?(填“是”或“否”)。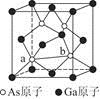
图2
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图2所示,其晶胞边长为cpm,则密度为g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为pm(用含c的式子表示)。
硼元素在化学中有很重要的地位。硼的化合物在农业、医药等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式。
从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是。
(3)在BF3分子中中心原子的杂化轨道类型是,SiF4粒子的空间构型是。又知若有d轨道参与杂化,能大大提高中心原子成键能力。试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF后者却是生成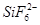 :。
:。
(4)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。下图是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为。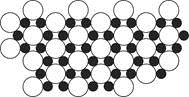
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为。
②下列叙述不正确的是。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含���6个σ键和1个大π键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是。
②六氰合亚铁离子[Fe(CN)6]4 -中不存在。
A.共价键 B.非极性键 C.配位键D.σ键 E.π键
写出一种与 CN-互为等电子体的单质的分子式。
(3)根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Ti属于区。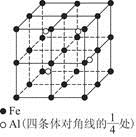
(4)一种Al—Fe合金的立体晶胞如图所示。请据此回答下列问题:
①确定该合金的化学式。
②若晶体的密度为ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为cm。
我国已研制出一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为。
(2)S与O为同主族元素,其中电负性较大的是;H2S分子中S原子杂化轨道类型为;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:。
(3)Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应可以生成NH2—NH2,NH2—NH2能否作配体?(填“能”或“否”)。
②CaO晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含有Ca2+数为;欲比较CaO与NaCl的晶格能大小,需考虑的数据是。
钾、镁、氟、硼等元素在每升海水中的含量都大于1毫克,属于海水中的常量元素。
(1)钾、镁、氟、硼电负性从大到小的排列顺序是。
(2)镓与硼同主族,写出镓元素原子的价电子排布式(即外围电子排布式):。
(3)用价层电子对互斥模型推断BF3和NF3的空间构型分别为、。
(4)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心。由钾、镁、氟形成的该化合物的化学式为,每个K+与个F-配位。