某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图:
(1)写出甲中通入甲醇这一极的电极反应式 。
(2)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ,原混合溶液中NaCl的物质的量浓度为 mol/L,CuSO4的物质的量浓度为 mol/L。(假设溶液体积不变)
(3)电解至t3时,消耗水的质量为 g。
已知下列两个热化学方程式:
H2(g)+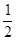 O2(g)==H2O(l) ΔH="-285" kJ/mol
O2(g)==H2O(l) ΔH="-285" kJ/mol
C3H8(g)+5O2(g)==3CO2(g)+4H2O(l)ΔH="-2" 220.0 kJ/mol
(1)实验测得H2和C3H 8的混合气体共5 mol,完全燃烧生成液态水时放热6 264.5 kJ,则混合气体中H2和C3H8的体积比是
(2)已知:H2O(l)==H2O(g)ΔH="+44.0" kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式。
0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态二氧化二碳和液态水,放出649.5kJ热量,其热化学反应方程式为:
又知H2O(l)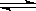 H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是J。
H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是J。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)=。
(2)用O2表示从0~2s内该反应的平均反应速率v= 。
(3)下图中表示NO2变化的曲线是
(4)800℃时,容器内起始压强和平衡后压强之比为___________________
(Ⅰ)苹果酸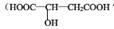 常用于汽水、糖果的添加剂;
常用于汽水、糖果的添加剂;
(1)写出苹果酸中官能团的名称___________________
(2)写出苹果酸分别与下列物质反应的化学方程式
① Na ② Na2CO3
(3)写出其一分子内酯化成四元环酯的结构简式: 。
(Ⅱ)CO,CH4均为常见的可燃气体。
(1)等体积的CO,CH4在相同的条件下分别完全燃烧,转移的电子数之比为 。
(2)120℃,101kPa下,a mL由CO,CH4组成的混合气体在b mL氧气中完全燃烧后,恢复至原来的温度与压强。
①若混合气体与氧气恰好完全反应,产生b mLCO2,则混合气体中CH4的体积分数为_______。
②若燃烧后气体体积缩小了a/4 mL,则a与b关系的数学表达式为___________。
苹果味饮料是一类由苹果发酵而成的酸性饮品,具有解毒、降脂等效果,其主要酸性物质为苹果酸。苹果酸在分离提纯后的化学分析如下:
①相对分子质量不超过150,完全燃烧后只生成CO2和H2O,分子中C、H的质量分数分别为35.82%和4.48%;②1mol该酸与足量的NaHCO3反应放出44.8L CO2,与足量的Na反应放出H233.6L(气体体积均为标况);③核磁检测,该分子中存在四种化学环境不同的碳原子,氢原子也处于五种不同的化学环境。请回答:
(1)分子中有个羧基,苹果酸分子式为。
(2)苹果酸的结构简式为: 。
(3)苹果酸的同分异构体中符合上述①、②两个条件的有
(写出任一种的结构简式)。
(4)该酸在一定条件下可以发生分子内脱水,其化学方程式为:。