室安卡因(G)是一种抗心率天常药物,可由下列路线合成;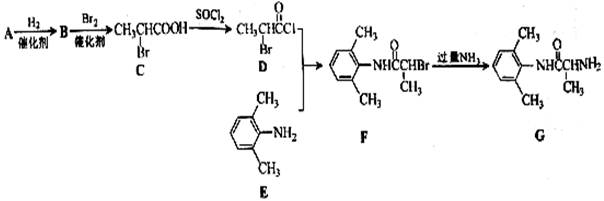
(1)已知A是 的单体,则A中含有的官能团是 (写名称)。B的结构简式是 。
的单体,则A中含有的官能团是 (写名称)。B的结构简式是 。
(2)C的名称(系统命名)是 ,C与足量NaOH醇溶液共热时反应的化学方程式是 。
(3)X是E的同分异构体,X分子中含有苯环,且苯环上一氯代物只有两种,则X所有可能的结构简式有 、 、 、 。
、 、 、 。
(4)F→G的反应类型是 。
(5)下列关于室安卡因(G)的说法正确的是 。
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d..属于氨基酸
(1)38 g某二价金属氯化物(ACl2)中含有0.8mol Cl-,则ACl2的摩尔质量是________;A的相对原子质量是____________;ACl2的化学式是__________。
(2)质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水。得到的溶液每亳升质量为q g,物质的量浓度为c。则溶质的相对分子质量为 。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离。相应的实验过程可用下图表示: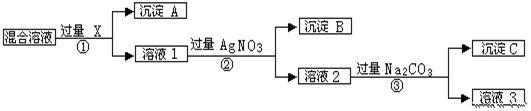
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X:_______, 沉淀A:_______,沉淀B:________.
(2)上述实验流程中加入过量的Na2CO3的目的是____________.
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式)杂质。
粗盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)如何运用最简方法检验溶液中有无SO42—?_________。如果有,应该如何除去SO42—? _____________
(2)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是_____________________________________。
(3)将经过操作(2)后的溶液过滤。请问这一操作能除掉哪些杂质? ________________。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:_____________________;过滤时:_________________;蒸发时:____________。
臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 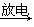 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为________g/mol(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________L。
(3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,充分加热后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为________。
(9分)(1)请简要叙述A. B图所示的实验装置、方法、操作中存在的错误。
AB
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。