(6分)某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
(1)配制150g质量分数为8% 的氢氧化钠溶液。
①计算:需要氢氧化钠固体的质量为____________g,水的体积为__________mL(水的密度近似看作1g/cm3)。
②称量:调节托盘天平平衡后,将烧杯放在托盘天平的左盘,称量其质量。然后_____ (按操作的先后顺序选填字母),直至天平平衡。
A.将氢氧化钠固体加入烧杯中 B.按需要添加砝码、移动游码
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温。
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签。
(2)下图表示向20 g某稀盐酸中逐滴加入氢氧化钠溶液时PH的变化情况。
①根据曲线判断,当加入25 g氢氧化钠溶液时,所得溶液中的溶质为___________(写化学式)。
②该盐酸中溶质质量分数为 。
③反思:氢氧化钠具有较强的吸水性,若称取的氢氧化钠已部分吸水,则所求得的盐酸中溶质质量分数将 (填“偏大”“偏小”或“无影响”)。
如图是汽车尾气中有毒气体转变为无毒气体的微观示意图,图中不同的圆球代表不同原子,请回答下列问题:
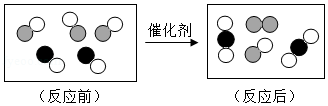
(1)该反应中参加反应的两分子的个数比为 ;
(2)该反中获取的信息 (微观解释)。
甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)三种物质中 的溶解度随温度变化趋势与气体溶解度的变化相似(填“甲”或“乙”或“丙”);
(2)将t2℃时甲、乙两物质的饱和溶液分别蒸发等质量的水,析出固体的质量甲 乙(填“>”、“<”或“=”);
(3)t1℃时用100g甲的饱和溶液配制成10%的甲溶液。需要加水的质量为 g;
(4)将t2℃时等质量的甲、乙、丙三种物质的饱和溶液同时降温至t1℃,所得溶液中溶质质量分数由大到小的顺序为 。

生活由处处有化学,请根据所学知识回答下列问题:
(1)端午节是我们的传统节日,某种粽子使用糯米、火腿瘦肉、食盐和少量油为原料,你认为还缺少的营养素为 (除水以外);
(2)山药中含有碱性皂角素,皮肤沾上会奇痒难耐,你认为可涂厨房中的 (调味品)来止痒,请再列举一个与此原理相同的实例 ;
(3)某食品包中的白色干燥剂是 (写俗称),其干燥的原理为(用化学方程式表示) ;
(4)净水时用 来吸附水中色素和异味,生活中用 (操作名称)降低水的硬度;
(5)除去粗盐中难溶性杂质的实验操作步骤为①溶解② ③蒸发④计算产率。
用化学用适表示:
(1)2个铁离子 ;
(2)葡萄糖 ;
(3)空气含量多的元素 。
请阅读下面的短文,根据内容回答问题。
多变的硫磺
硫单质俗称硫磺,质脆、密度比水大、不溶于水、微溶于酒精、熔点沸点都不高。硫在加热或点燃的条件下可以和氢气、大多数金属单质、氧气、浓硝酸等反应,发生反应的化学方程式如下:
①S+H2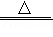 H2S ②S+2Cu
H2S ②S+2Cu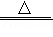 Cu2S ③S+O2
Cu2S ③S+O2 SO2
SO2
④S+Hg═HgS ⑤S+6HNO3(浓)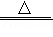 H2SO4+6X↑+2H2O
H2SO4+6X↑+2H2O
硫元素在不同的物质中呈现多种化合价。在化学反应中硫元素化合价升高体现硫的还原性,化合价降低体现氧化性。
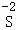

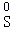
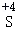 (或
(或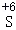 )
)
自然界中单质硫存在于火山口附近,以化合物形式存在的硫元素多以硫化物、硫酸盐等形式存在。硫磺具有广泛的用途。在工业上主要用于制造硫酸、化肥、硫化橡胶、火药、烟花等;在农业上用于制造杀虫剂等;在医药上制造硫磺软膏。
(1)硫磺的用途有 (写出一条);
(2)反应⑤的化学方程式中X的化学式 ;
(3)短文中的5个化学方程式能体现硫的还原性的有 (填序号);
(4)含硫煤在燃烧过程中容易产生SO2气体,溶于水会形成 ,导致环境污染。