乙醇汽油是一种由粮食及各种植物纤维加工成的燃料乙醇,和普通汽油按一定比例混配形成的新型替代能源。有人指出,近年来冬季北方路面经常结冰,是由于大量使用乙醇汽油,而乙醇燃烧时,会产生比普通汽油更多的水的原因导致的。某校研究性学习小组设计了如下实验,测定学校附近加油站的93号汽油中乙醇的含量,并比较乙醇燃烧与普通汽油燃烧产生水的量。
甲同学认为,分离互溶的液体混合物最好的方法就是蒸馏,只要通过蒸馏并收集乙醇汽油中的乙醇就可以计算其含量。于是,他设计了按下图装置进行的蒸馏实验,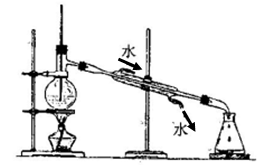
⑴请找出上图装置中的两处错误: , 。
经查阅相关资料得到乙醇及普通汽油主要成分(5—11碳的烷烃)的沸点如下表:
| 有机物 |
乙醇 |
戊烷 |
己烷 |
庚烷 |
辛烷 |
壬烷 |
癸烷 |
十一烷 |
| 沸点/℃ |
78.4 |
36.1 |
68.7 |
98.5 |
125.8 |
150.8 |
174.1 |
195.6 |
⑵乙同学根据上表中的数据提出,甲同学的方案不易实施,得不到纯净的乙醇,请简述其中的原因: 。
⑶乙同学根据查阅的资料提出:可以用水萃取乙醇汽油中的乙醇,以此实现分离乙醇的目的。向分液漏斗中加入乙醇汽油和蒸馏水,如想使乙醇全部进入水层需要进行的操作是: ;静置分层后普通汽油在 层(填“上”或“下”)。通过测定普通汽油的质量与原乙醇汽油的质量就可计算出乙醇的质量分数。
⑷燃烧时产生水的多少是由有机物的含氢量(氢元素的质量分数)决定的,根据上表中普通汽油的成分可知,普通汽油中含氢量最高的是: (填分子式)、最低的是: (填分子式);则等质量的乙醇与这两种有机物相比较,完全燃烧时产生水的质量最小的
是: (填分子式)。
Ⅰ.对于混合物的分离或提纯,常采用的方法有:①过滤②蒸发结晶③蒸馏④萃取⑤洗气⑥加热分解等。请选用合适的方法序号完成下列填空。
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)除去H2中的CO2,可用的方法除去。
(3)为了从氯化钾和二氧化锰的混合物中获得氯化钾,可先加足量的水溶解,过滤,将得到的滤液
,就可得到氯化钾晶体。
(4)除去氧化钙中的碳酸钙,可用的方法。
(5)从溴水中提取溴单质,可用 方法。
方法。
(6)分离沸点相差较大的液体混合物,可用方法。
Ⅱ.下列仪器常用于物质分离的是__________________(填序号)
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图。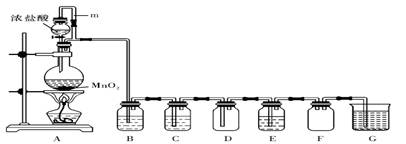
(1)圆底烧瓶中发生反应的化学方程式为 。
(2)A 中m 管的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是。
(4)E中若装有FeCl2 溶液,反应的离子方程式为;
E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,某中学高一化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2 中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是;
实验c的目的是。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是。
下图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器.铁架台.试管夹均未画出)。图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验需要加热的仪器按加热的先后顺序排列为(填序号)。
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是。
(3)写出B处的现象。
某同学为了验证海带中含有碘,拟进行以下实验,请回答相关问题。
(1)第1步:灼烧。操作时将足量海带灼烧成灰烬,该过程中将使用到的硅酸盐质实验仪器有(填代号,限填3项)
A.试管 B.瓷坩埚 C.坩埚钳 D.三脚架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是。
(3)第3步:氧化的操作中依次加入合适的试剂。下列氧化剂最好选用(填代号)
A.浓硫酸 B.新制氯水 C.高锰酸钾溶液 D.双氧水
(4)第4步:碘单质的检验,操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含有碘。
某化学小组以苯甲酸为原料制取苯甲酸甲酯,并用制得的苯甲酸甲酯进行碱性水解的实验。
I.制取苯甲酸甲酯:已知有关物质的沸点如下表:
| 物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
| 沸点/℃ |
64.7 |
249 |
199.6 |
实验装置如下:
(1)简述第一步混合液体时,最后加入浓硫酸的理由是
。
若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:
。
(2)分液时上层液体从出来;接受馏分时温度控制在。
(3)此制取过程比教材中乙酸乙酯的制备复杂很多,写出用此过程制备苯甲酸甲酯的两大优点:、。
II、苯甲酸甲酯碱性水解

(4)写出苯甲酸甲酯碱性水解的化学反应方程式。
(5)写出苯甲酸甲酯碱性水解实验装置中A的作用。
III、苯甲酸甲酯有多种同分异构体
(6)符合下列条件的结构
①可以发生银镜反应②属于芳香族化合物③不具备其它环状结构④不能与FeCl3发生显色反应;共有种。