①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题: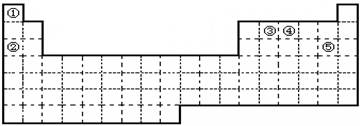
(1)上述五种元素中,金属性最强的元素在周期表中的位置是 ,
该元素的单质在空气中加热的化学方程式为 。
(2)元素①和④形成化合物的电子式是 ,其水溶液呈 (填“碱性”、“酸性”或“中性”)。
(3)试用电子式表示元素⑤单质分子的形成过程 。
(10分) 将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如右图所示。当V1=140mL时,则金属粉末中n(Mg)= mol,V2= mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入480 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:
(4)若滴加NaOH溶液致V2ml时,停止滴加NaOH溶液,开始往溶液中通入足量CO2,请写出发生反应的离子方程式——————————————————————-————。
(9分)有一透明溶液,可能含有Al3+、Fe3+、K+、Mg2+和Cu2+、 CO32-、SO42-等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。而且加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。
试推断:
(1)原溶液中一定含有——————————;
(2)一定不含有————————————————;
(3)可能含有————————;为了进一步确定可能含有的离子,请简述实验操作过程—————————————————————————。
已知有以下物质相互转化
试回答:(1)写出B的化学式 ;D的化学式
(2)写出由E转变成F的化学方程式
(3)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式。
(12分)
(1)鉴别KCl溶液和K2CO3的试剂是 ;离子方程式为
(2)除去混入FeCl3溶液中少量FeCl2杂质的试剂是 ,离子方程式为.
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为。
(4)除去混入MgO少量Al2O3杂质的试剂是————————,离子方程式为——————————。
根据下面的合成路线及所给信息填空: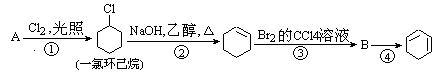
(1)A的结构简式是,名称是
(2)①的反应类型是、③的反应类型是
(3)反应④的化学方程式是