我国首创的海水电池以铝为负极,铂网为正极,海水为电解质溶液。空气中的氧气与铝反应产生电流,电池总反应为:4Al + 3O2+ 6H2O=4Al (OH )3,下列说法正确的是( )
| A.电池工作时,电流由铝电极沿导线流向铂电极 |
| B.以网状的铂为正极,可增大与氧气的接触面积 |
| C.为了增加海水的导电性,向海水中加人大量食盐 |
| D.负极反应:O2+ 2H2O+ 4e-=4OH一 |
一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)
A(s)+B(g)  C(g)+D(g) ΔH ="+100" kJ·mol-1,某时刻测得部分数据如下表:
C(g)+D(g) ΔH ="+100" kJ·mol-1,某时刻测得部分数据如下表:
| 容器编号 |
n(B)/mol |
n(C)/mol |
n(D)/mol |
反应时间/min |
反应速率 |
| Ⅰ |
0.06 |
0.60 |
0.10 |
t1 |
v(正)=v(逆) |
| Ⅱ |
0.12 |
1.20 |
0.20 |
t2 |
|
| Ⅲ |
0.32 |
1.0 |
0 |
0 |
|
| Ⅳ |
0.12 |
0.30 |
v(正)=v(逆) |
下列说法正确的是 ( )
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ中反应至平衡时吸热20 kJ
D.容器Ⅳ中c(D)=" 0.4" mol·L-1
下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
| A.1L0.1mol·L-1(NH4)2Fe(SO4)2溶液: c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| B.25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中: c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| C.25℃时,BaCO3饱和溶液(Ksp =8.1×10-9): c(Ba2+)= c(CO32-)>c(H+) = c(OH-) |
| D.1.0 mol·L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
某蓄电池放电、充电时反应为:Fe+ Ni2O3 +3H2O  Fe(OH)2 +2Ni(OH)2下列推断不正确的是()
Fe(OH)2 +2Ni(OH)2下列推断不正确的是()
| A.放电时,Fe为正极,Ni2O3为负极 |
| B.充电时,阴极上的电极反应式是:Fe(OH)2 +2e-→Fe+2OH- |
| C.放电时,负极上的电极反应式是:Ni2O3 +3H2O+2e-→2Ni(HO)2 +2OH- |
| D.该蓄电池的电极必须是浸在某种碱性电解质溶液中 |
下列图示与对应的叙述相符的是 ( )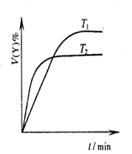
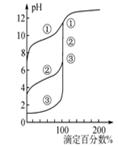
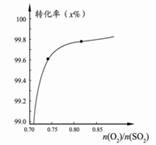
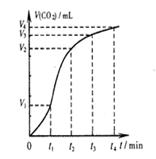
图1图2图3图4
A.图1表示可逆反应“2X(g) Y(g)△H <0”,温度T1<T2的情形 Y(g)△H <0”,温度T1<T2的情形 |
| B.用0.1000 mol·L-1NaOH溶液分别滴定浓度相同的三种一元酸,由图2曲线可确定①的酸性最强 |
C.在其它条件不变时,2SO2(g) +O2(g)  2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率 2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率 |
| D.图4表示碳酸钙与盐酸反应收集到气体最多的时间段是t3~t4 |
下列关于难溶电解质溶液说法正确的是 ( )
| A.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| B.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |
| C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl- |
| D.25 ℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大 |