实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按右图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。④分离出乙酸乙酯层、洗涤、干燥。
(1)反应中浓硫酸的作用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
| A.中和乙酸和乙醇。 |
| B.中和乙酸并吸收部分乙醇。 |
| C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。 |
| D.加速酯的生成,提高其产率。 |
(3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有 __________;分离时,乙酸乙酯应该从仪器 ________ (填:“下口放” 或“上口倒”)出。
用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器从图示所列中选用,N2和O2的用量可自由控制)。已知:①NO+NO2+2OH-→2NO+H2O②气体液化温度:NO2 21℃,NO-152℃
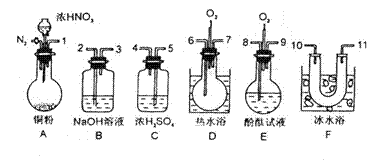 |
试回答:
(1)仪器的连接顺序(按左→右连接,填各接口的编号)为。
(2)反应前应通入N2,目的是。
(3)装置F的作用是。
(4)确认气体中含NO的现象是。
(5)若通入O2过量则B中反应的化学方程式为。
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”,请分别用下图中示意的两套仪器装置,制取上速铁的氧化物和“引火铁”,实验中必须使用普通铁粉、6molL-1盐酸,其它试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
填写下列空白:
(1)实验进行时试管A中应加入的试剂是
烧瓶B的作用是;
烧瓶C的作用是
在试管D中收集得到的是
(2)实验时,U型管G中应加入的试剂是
分液漏斗H中应加入
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应字母)
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是
(5)试管E中发生反应的化学方程式是
(6)为了安全,在E管中的反应发生前,在F出口处必须;E管中反应开始后,在F出口处应
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或PH值控制可参考下列附表确定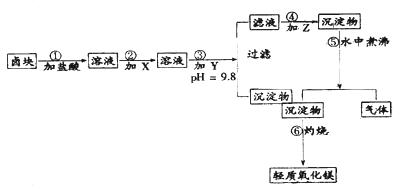
轻质氧化镁生产工艺流程图
表1生成氢氧化物沉淀的PH值
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 |
2.7 7.6 8.3 9.6 |
3.7 9.6 9.8 11.1 |
*)注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常常将它氧化成为Fe3+,生成
Fe(OH)3沉淀而去除之。
表2化学试剂价值表
| 试剂 |
价格(元/t) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) |
450 2400 2100 600 310 |
请填写以下空白:
(1)在步骤②加入的试剂X,最佳选择应是,其作用是。
(2)步骤③加入的试剂Y应是;之所以要控制pH=9.8,其目的是。
(3)在步骤⑤时发生的化学反应方程式是:
请你选用下图所示仪器和药品,按实验室要求,设计一套完整的检验一氧化碳还原性和二氧化碳化学性质的实验,并回答下列问题:
实验药品:盐酸、石灰石、氧化铜粉末、木炭粉、氢氧化钙溶液。
(1)实验装置连接顺序依次为(用字母表示)___________;
(2)A装置的药品是_________,发生反应的化学方程式为_______________________;
(3)B装置中产生的实验现象是_________,发生反应的化学方程式为____________
(4)C装置中发生反应的化学方程式为____________________________________;
(5)D装置中产生的现象是_________;
(6)尾气中含有毒气体,排放到空气中会造成污染,处理方法是_________。

提供的试剂:饱和Na2CO3溶液饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称)。