有一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子。
(1)该融雪剂的化学式是_________;X与氢元素形成的化合物的电子式是_______________。
(2)主族元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________;D与E能形成一种分子,该分子的结构式为__________________;D所在族元素的氢化物中,沸点最低的是(填名称)_________;X与E形成的离子化合物 XE2中 (填“有”“无”)共价键。
(3)短周期元素W与Y同周期其单质是半导体材料;元素Z的单质分子Z2中由3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是_________。
(4)用化学式回答:①D与Y的氢化物稳定性__ __>______ ;
;
②最高价氧化物对应水化物酸性__ __> ____。
依据事实,写出下列反应的热化学反应方程式。
(1)在25℃、101kPa下,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为。
(2)若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量,则表示该反应的热化学方程式为。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,则表示该反应的热化学方程式为 _________________________________________________。
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为。
物质A~F有如图所示的转化关系。已知A、B、C均为单质,且室温下A为用途广泛的金属、B为黄绿色气体、C为密度最小的无色气体,E为气体,E溶液呈强酸性且无色,D溶液呈黄色。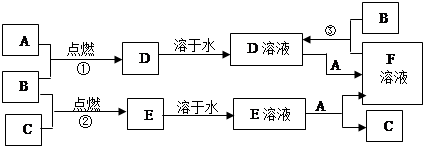
请回答下列问题:
(1)写出下列物质的化学式:A、B 、C 、D 、E 、F 。
(2)写出反应②的化学方程式:。
(3)写出反应③的离子方程式:。
写出实验室制取NH3的化学反应方程式为_______;常用干燥NH3 ;收集时应用法收集;检验NH3是否已充满试管的方法是。
氯气的用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅等。
(1)工业上可用氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是。
(2)工业上生产半导体材料硅的流程如下:
①写出制备粗硅时反应的化学方程式:。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点、难挥发性液态杂质,必须进行分离提纯,其提纯方法为(填字母)。
| A.蒸馏 | B.过滤 | C.萃取 | D.结晶 |
(3)为防止污染空气,常用溶液吸收多余的氯气。
已知氧化还原反应与四种基本反应类型的关系可用如图表示,下列是有水参加或生成的几种反应:
①CaO+H2O =Ca(OH)2
②2Na+H2O=2NaOH+H2↑
③H2+CuO  Cu +H2O
Cu +H2O
④3S+6NaOH  2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH+HCl=NaCl+H2O
请回答下列问题:
(1)反应①中水(填字母)。
| A.是氧化剂 |
| B.是还原剂 |
| C.既是氧化剂又是还原剂 |
| D.既不是氧化剂又不是还原剂 |
(2)反应③被氧化的元素是(填元素符号)。
(3)上述反应中,属于区域Ⅲ的是 (填序号)。
(4)写出一种符合区域Ⅴ且既有沉淀生成又有水生成的离子方程式:。