高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:
2Fe(OH)3 + 3Cl2 + 10KOH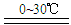 2K2FeO4 + 6KCl + 8H2O
2K2FeO4 + 6KCl + 8H2O
对于该反应,下列说法正确的是
| A.该反应是置换反应 | B.钾元素化合价降低 |
| C.Fe(OH)3发生还原反应 | D.Cl2是氧化剂 |
某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是
A.K+、Na+、HCO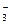 、NO 、NO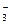 |
B.Na+、SO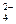 、Cl—、ClO— 、Cl—、ClO— |
C.H+、Mg2+、SO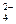 、NO 、NO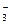 |
D.Ag+、K+、NO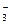 、Na+ 、Na+ |
将铜片和铝片用导线连接后插入盛有浓硝酸的烧杯中组成原电池,此原电池的负极及其电极反应分别是
| A.Al, Al- 3e-=Al3+ | B.Cu, Cu-2e-=Cu2+ |
| C.Al, 2H++2e-=H2↑ | D.Cu, 2H++NO3-+e-=NO2↑+H2O |
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知 H2O(g)=H2O(l);△H1=Q1 kJ/mol
C2H5OH(g)=C2H5OH(l);△H2=Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=Q3 kJ/mol
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
| A.Q1+Q2+Q3 | B.0.5(Q1+Q2+Q3) |
| C.1.5Q1-0.5Q2+0.5Q3 | D.0.5Q1-1.5Q2+0.5Q3 |
常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池(如右图)中,氢气和氮气在电极上合成了氨气。用来合成的电解质在电解池中起传导H+的作用,它是一种固体复合氧化物(缩写为SCY),电解池的两个电极则是吸附在SCY内外表面上的金属钯多晶薄膜。下列说法中不正确的是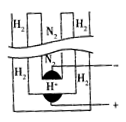
| A.阳极的反应式为 H2-2e-=2H+ | B.阴极的反应式为 N2+6e-+6H+=2NH3 |
C.电解的总反应式 N2+3H2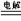 2NH3 2NH3 |
D.电解的总反应式为 3H++ N3-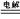 NH3 NH3 |
下列关于浓硫酸的叙述正确的是
| A.浓硫酸具有吸水性,因而能使蔗糖炭化 |
| B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
| C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 |
| D.浓硫酸在常温下能够使铁、铝等金属钝化 |