设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1mol碳烯(:CH2)中含有的电子数为6NA |
| B.3.2 g铜与足量硫加热充分反应,电子转移总数为0.1NA |
| C.100mL 0.1mol·L-1的FeCl3溶液中含有Fe3+的个数为0.01NA |
| D.常温常压下,甘油(C3H8O3)和甲苯(C7H8)的混合物46g中含有4NA个氢原子 |
下列事实不能用勒夏特列原理解释的是
| A.热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好 |
| B.配制FeCl3溶液时,在溶液中加入少量稀盐酸 |
| C.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快 |
| D.新制的氯水在光照条件下颜色变浅 |
已知在t1、t2温度下水的电离平衡曲线如图所示,则下列说法中不正确的是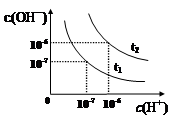
| A.t1<t2 |
| B.一定温度下,改变水溶液中c(H+)或 c(OH-)的浓度,Kw不会发生变化 |
| C.t2温度pH值为2的HCl溶液中,水电离出的c(H+)=1×10-10mol·L-1 |
| D.将t1温度下0.1 mol·L-1的盐酸稀释,溶液中所有离子的浓度均相应减小 |
常温下,0.1 mol·L-1某一元酸(HA)溶液中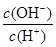 =10-8,下列叙述正确的是
=10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中由水电离出的H+浓度为c(H+)=1.0×10-11 mol·L-1
C.该溶液中水的离子积常数为1.0×10-22
D.在0.1 mol·L-1某一元酸(HA)溶液中,水的电离被促进
家用炒菜锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不会发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e-=4OH- | D.Fe-3e-=Fe3+ |
常温下,pH值为11的NaOH溶液与pH值为11的CH3COONa溶液中,水电离的c(OH-)之比为
| A.1∶1011 | B.1∶103 | C.1∶108 | D.108∶1 |