在Na2SO4和Al2(SO4)3的混合溶液中,如果[SO42-]=0.3mol•L-1,当加入等体积的0.2 mol/L的NaOH溶液时,生成沉淀恰好完全溶解,则原混合溶液中Na+物质的量浓度是:
| A.0.5 mol/L | B.0.3 mol/L | C.0.45 mol/L | D.0.225 mol/L |
已知乙烯醇(CH2=CH—OH)不稳定,可自动转化为乙醛。乙二醇在一定条件下发
生脱水反应,也有类似现象 发生,
发生, 所得结构简式有人写出下列几种,其中不可能的是
所得结构简式有人写出下列几种,其中不可能的是
①CH2="CH2" ②CH3CHO ③ ④
④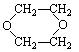
| A.① | B.②③ | C.③④ | D.①④ |
以下化学用语正确的是
| A.苯的最简式 C6H6 | B.乙醇的分子式CH3CH2OH |
C.乙烯的结构简式CH2CH2 |
D.甲醛的结构式: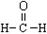 |
下列各组均属于纯净物的是
| A.福尔马林、白酒、食醋 | B.甘油、氯仿、乙醇钠 |
| C.苯、汽油、无水乙醇 | D.二氯乙烷、聚氯乙烯、苯酚 |
反应aA(g)+bB(g)  cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
回答问题:
(1) 反应的化学方程式中,a:b:c为_____________;
(2) A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为_________;
(3) 由第一次平衡到第二次平衡,平衡移动 的方向是_________,采取的措施是________;
的方向是_________,采取的措施是________;
(4) 比较第Ⅱ阶段反应温度(T2) 和第Ⅲ阶段反应温度(T3)的高低:T2T3(填“>”“<”“=”),判断的理由是_________________________________________;
和第Ⅲ阶段反应温度(T3)的高低:T2T3(填“>”“<”“=”),判断的理由是_________________________________________;
(5) 达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中各物质的浓度 随时间变化的趋势(曲线上必须标出A、B、C)。
随时间变化的趋势(曲线上必须标出A、B、C)。
碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉 积在管壁上的钨可以发生反应:W(s)+I2(g)
积在管壁上的钨可以发生反应:W(s)+I2(g)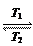 WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是()
WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是()
| A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W重新沉积到灯丝上 |
| B.灯丝附近温度越高,WI2(g)的转化率越低 |
C.该反应的平衡常数表达式是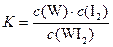 |
| D.利用该反应原理可以提纯钨 |