A、B、C、D,E和F是六种短周期元素,它们的原子序数依次增大。 A和D,C与F为同主族元素;A的单质是最轻的气体; B元素最高价氧化物的水化物与其气态氢化物反应生成盐; E元素是地壳中含量最多的金属元素。F元素原子M层上电子数比L层少2个电子。试完成下列填空
(1)E元素位于周期表的第 周期 族。
(2)F简单阴离子的结构示意图 。
(3)A、C、D 三种元素共同形成的化合物的电子式 ,其微粒间存在的化学键有 。
(4)铜与B元素最高价氧化物的水化物的稀溶液反应的离子方程式为 。
(5)E的硫酸盐溶液中滴入B元素气态氢化物的水溶液,直至过量。离子方程式为 。
汽油不仅是最重要的燃料,而且是重要的化工原料,它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如已烷变成苯,庚烷变成甲苯,这个变化叫异构化。请根据以汽油为原料的下列衍变关系,写出相应的化学方程式(有机物写结构简式),在括弧中填反应类型。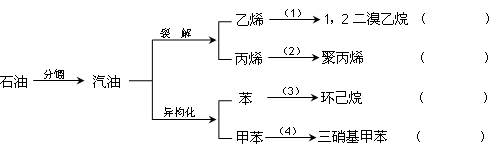
⑴
⑵
⑶
⑷
现有下列各化合物: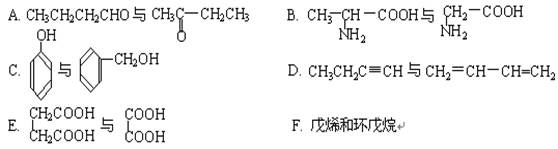
①上述各组化合物属于同系物的是,属于同分异构体的是(填入编号)。
②上述化合物中的含氧官能团是(写名称);
根据官能团的特点可将C中两化合物划分为类和类。
③若将A中两化合物看作是某单烯烃被酸性高锰酸钾溶液氧化生成的,则该单烯烃的结构简式为。
有机物A CH3CHClCH2OH,在一定条件下可以发生如下图所示的转化(其它产物和水已略去):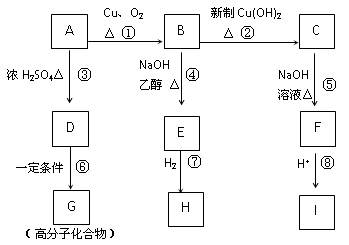
请回答下列问题:
(1)写出下列物质的结构简式:E,I。
(2)上述①~⑧的反应中,是取代反应,是消去反应(填编号)。
(3)写出下列反应的化学方程式:
A→B B→E;D→G __
已知元素的电负性是分子内一个原子吸引电子的能力,能力越大,电负性越大,非金属性越强。电负性和原子半径一样,也是元素的一种基本性质,下面给出14种元素的电负性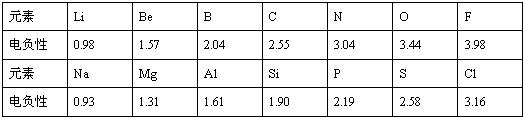
请结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是
(2)预测下列两组元素电负性的大小关系:KCa ,NaK(填“大于”、“小于”或者“等于”)。
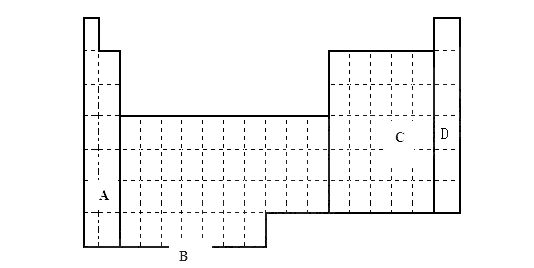
(1)在上面元素周期表中全部是金属元素的区域为。
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等
①用元素符号将甲乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是(填名称),可以验证该结论的实验是。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性