反应N2O4(g) 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )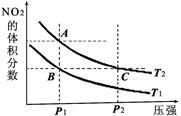
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B<C
在配制一定物质的量浓度的NaOH溶液时,下列情况会造成所配溶液的浓度偏高的是B
| A.所用NaOH已经潮解 | B.定容时观察液面仰视 |
| C.有少量NaOH溶液残留在烧杯里 | D.称NaOH时,砝码已生锈 |
将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是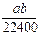
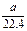
| A. mo1·L-1 | B. mol·L-1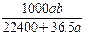 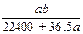 |
C. mol·L-1 | D. mol·L-1 |
下列离子方程式改写成化学方程式正确的是
| A.Cu2++ 2OH- = Cu(OH) 2↓ CuCO3+2NaOH = Cu(OH) 2↓+Na2CO3 |
| B.CO32-+ 2H+= CO2↑十H2O BaCO3+2HCl = BaCl2+CO2↑十H2O |
| C.Ca2++ CO32- = CaCO3↓ Ca(NO3)2+Na2CO3 = CaCO3↓+2NaNO3 |
| D.H++ OH- ="" H2O Ba(OH)2+H2SO4 = BaSO4 ↓十2H |