三种短周期元素x、y、z对应的单质 X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如右图所示的变化。已知B分子组成中z原子个数比C分子中少一个。
请回答下列问题:
(1)元素x的原子结构示意图 ;元素y在周期表中的位置是 ;
(2)已知C的浓溶液与浓盐酸相遇可产生白烟,写出白烟成分的电子式: 。
(3)C与X在一定条件下生成化合物A的化学方程式: 。
(4)一定条件下,A与C反应可生成Y和B,请写出该反应的化学方程式;并用单线桥法标出电子转移的方向与数目。
。
(5)用电子式表示B的形成过程 。
(每空2分,共16分)依据事实,填空:
(1)在25℃、101kPa下,1g甲醇液体完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(3)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式:正极:;负极:
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
该反应的反应方程式可表示为,平衡时Y气体的转化率。
(5)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为;若X的核内中子数为20,则37 g XCl2中所含质子的物质的量。
(每空2分,共8分)某有机物完全燃烧生成标准状况下CO2的体积为4.48L,H2O的质量为5.4g,
(1)若此有机物的质量为3g,则此有机物的结构简式是______________________;
(2)若此有机物的质量为4.6g,则此有机物的结构简式是____________________;
(3)若此有机物的质量为6.2g,且此有机物1mol能和金属钠反应生成1molH2,则此有机物的结构简式是__________________;
(4) 等物质的量的此三种有机物完全燃烧,消耗氧气最多的是(名称)____________。
(6分) 一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
回答下列问题:
(1)化合物Ⅲ生成化合物Ⅳ的副产物为_____________。(提示:原子利用率100%,即原子全部都转化成产物)
(2)CH2=CH2与溴水反应方程式:__________________________________.
(3)写出合成路线中从化合物Ⅳ到化合物Ⅴ的反应方程式:
_____________________________________________________________。
(4)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是
| A.化合物Ⅲ可以发生氧化反应 |
| B.化合物Ⅲ不可以与NaOH 溶液反应 |
| C.化合物Ⅳ能与氢气发生加成反应 |
| D.化合物Ⅲ、Ⅳ和Ⅴ均可与金属钠反应生成氢气 |
E.化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
F.化合物Ⅴ可以发生水解反应
(5分) 请观察下图装置,回答下列问题: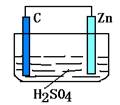
(1) 负极是________,发生_______反应(填氧化或还原)
(2) 正极是________,发生_______反应(填氧化或还原)
(3) 正极的电极反应式:__________________________.
(4分)( 1)为了检验和除去下表中的各种杂质(括号里的物质),请从(I)中选出适当的检验试剂,从(II)中选出适当的除杂试剂,将所选的答案的序号填入相应的空格内。
| 物质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
||
| 酒精(水) |
(I)检验的试剂:
| A.无水硫酸铜 | B.酸性高锰酸钾溶液 | C.盐酸 | D.氢氧化钠溶液 ( II)除杂试剂:a.硫酸 b.酸性高锰酸钾溶液 c.新制的生石灰 d.溴水 |