右图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:
| 纯牛奶 保持期:8个月 净含量:250mL/盒 营养成分:(每100mL) 钙≥0.1lg 脂肪≥3.3g 蛋白质≥2.9g |
(1)包装标签上脂肪≥3.3g,是指100mL牛奶中至少含有3.3g的脂肪。那么一盒牛奶中至少含有 g 脂肪(保留到0.01g)。
(2)人体中的钙主要以羟基磷酸钙晶体[Ca10(PO4)6(OH)2]形式存在。羟基磷酸钙的相对分子质量为 ;羟基磷酸钙中钙元素的质量分数是 (保留到0.1%)。
(3)人体中含量最高的金属元素 (填“是”或“不是”)钙。
(4)若人体每天至少需要0.6g钙,且这些钙有90%来自牛奶,则一个人每天至少要喝 盒牛奶,书写另一可用于补钙的食物 。
实验室中有一瓶标签被腐蚀的盐酸,小明为了测定该盐酸的溶质质量分数,取5g 8%的氢氧化钠溶液,先滴加2滴酚酞溶液,再加该盐酸,边滴边振荡,至溶液恰好变成无色为止,共消耗了5g该盐酸。请计算该盐酸的溶质质量分数。
将氯化钠和碳酸钠组成的固体混合物18.9克完全溶解于196.8克水中,向该溶液中 加入一定质量的氯化钡溶液恰好完全反应,滤出19.7克沉淀。若将滤液蒸发100克水后,所得溶液溶质质量分数为10%。
计算:(1)蒸发水后所得溶液的质量。
(2)所用氯化钡溶液中溶质的质量分数。
根据下图所示的实验过程和所提供的数据回答问题。(假设恰好完全反应,C中所生成的气体全部逸出)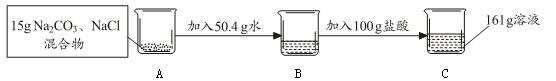
已知所发生反应的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O
请计算回答:
(1)水(H2O)分子中,氢、氧元素的原子个数比为;
(2)反应生成CO2的质量为g;
(3)计算所用稀盐酸的溶质质量分数。(要求写出计算过程)
(4)若取C溶液10 g配制成20﹪的溶液,需加入30﹪的氯化钠溶液多少克?
(要求写出计算过程)
桂林人喜欢吃火锅,常用的火锅燃料是一种俗称“固体酒精”的物质。已知“固体酒精”是用酒精(C2H5OH)、醋酸钙和水按一定比例制成的“胶冻”。
(1)C2H5OH中C、H、O原子个数比为____________。
(2)若“固体酒精”充分燃烧时,只发生反应:C2H5OH + 3O2 2CO2 + 3H2O。现取“固体酒精”30g,充分燃烧后生成44 g CO2。请计算“固体酒精”中C2H5OH的质量分数是多少?(结果保留一位小数)
2CO2 + 3H2O。现取“固体酒精”30g,充分燃烧后生成44 g CO2。请计算“固体酒精”中C2H5OH的质量分数是多少?(结果保留一位小数)
农业生产上常用溶质质量分数为16%的氯化钠溶液来选种。
(1)要配制200Kg16%的氯化钠溶液,需氯化钠的质量为Kg和水的质量为Kg。
(2)选种进行一段时间后,农技员估计溶液和溶质质量分数都有所减少,他取出50g氯化钠溶液,加入过量AgNO3溶液,得到沉淀14.35g。请你计算:
①AgNO3中银、氮、氧元素的质量比为。
②氯化钠溶液中溶质的质量分数。(最后计算准确到0.1%)
(反应原理:AgNO3+NaCl=AgCl↓+NaNO3)